题目内容
下列各装置中,烧杯中盛有海水,能够形成原电池并且铁为正极的是( )
A、 |
B、 |
C、 |
D、 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,能够形成原电池,说明符合原电池的构成条件,且铁作正极,则铁的活动性较负极材料弱.
解答:
解:A.该装置中没有两个电极,所以不能构成原电池,故A错误;
B.该装置中铁比Sn易失电子而作负极,故B错误;
C.该装置符合原电池构成条件,且锌易失电子作负极、铁作正极,故C正确;
D.该装置符合原电池构成条件,铁易失电子作负极、Cu作正极,故D错误;
故选C.
B.该装置中铁比Sn易失电子而作负极,故B错误;
C.该装置符合原电池构成条件,且锌易失电子作负极、铁作正极,故C正确;
D.该装置符合原电池构成条件,铁易失电子作负极、Cu作正极,故D错误;
故选C.
点评:本题考查了原电池原理,明确原电池的构成条件及金属失电子难易程度即可解答,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列变化中,发生氧化反应的是( )
| A、CaO→Ca(OH)2 |
| B、Cu2+→Cu |
| C、Fe2+→Fe3+ |
| D、CO2→CO |
下列溶液中有关物质的量浓度关系和计算不正确的是( )
| A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2] |
| B、已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol?L-1 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-1 |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH>1 |
| D、室温下,0.1mol?L-1 NaHA溶液的pH=4,则有C(HA-)>C(H+)>C(A2-)>C(H2A) |
在下列反应中,HCl做还原剂的是( )
| A、Zn+2HCl=H2↑+ZnCl2 | ||||
| B、CaCO3+2HCl=CO2↑+CaCl2+H2O | ||||
C、MnO2+4HCl(浓)
| ||||
| D、HCl+KOH=KCl+H2O |
下列操作能达到预期目的是( )
| A、石油分馏时把温度计插入液面下 |
| B、向银氨溶液中加入几滴乙醛后用酒精灯加热至沸制银镜 |
| C、在试管内加入少量蔗糖溶液,再加3-5mL稀硫酸小心煮沸几分钟后冷却,加新制Cu(OH)2,煮沸,有红色沉淀生成 |
| D、用乙醇、醋酸和18mol/L的硫酸混合加热制乙酸乙酯 |
正丙醇蒸气与空气混合通过热铜网,生成一种化合物,与该化合物互为同分异构体的是( )
| A、CH3CH2OCH3 |
B、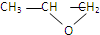 |
C、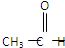 |
| D、CH3COOCH3 |
2000K时,反应CO(g)+
O2(g)?CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)?2CO(g)+O2(g)的平衡常数K′为( )
| 1 |
| 2 |
A、
| ||||
| B、K2 | ||||
C、
| ||||
D、
|
在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析等,下列各组混合物的分离或提纯选用方法最合适的是( )
| A、除去AgI胶体中混有的I-离子--过滤、洗涤、干燥 |
| B、除去苯中含有的少量苯酚--加入NaOH溶液、分液 |
| C、分离CuSO4?5H2O和BaSO4的混合物--溶解、过滤 |
| D、除去乙酸乙酯中混有的乙酸杂质--加入NaOH溶液、分液 |