题目内容
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
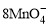 +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
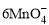 +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式
______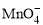 +______Fe2++______H+ =______Mn2++______Fe3++___
+______Fe2++______H+ =______Mn2++______Fe3++___ ___H2O
___H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)混合物中Cu2S的质量分数为_____________。
 阅读快车系列答案
阅读快车系列答案| A. | Fe3O4是还原剂 | B. | CO是氧化剂 | ||
| C. | 1mol Fe3O4得到6mol电子 | D. | 4molCO失去8mol电子 |
| A. | 可以用四氯化碳把溴水中的溴萃取出来,振荡静置分层后,下层液体为无色 | |
| B. | 萃取分液时,从分液漏斗下口流完下层液体,及时关闭.再打开流出上层液体 | |
| C. | 碘易溶于酒精,微溶于水,故可以用酒精萃取碘水中的碘 | |
| D. | 萃取之后,一般通过分液漏斗将互不相溶的液体分离 |
| A. | Na+、Mg2+、Cl-、SO42- | B. | Mg2+、Ca2+、HCO3-、Cl- | ||
| C. | Ba2+、Al3+、Cl-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。据此回答下列问题:
(1)L的常见原子组成符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用具体元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ,B的结构式为 。Z和L也能组成原子数目比2∶4的分子C, 已知1 mol 液态C和液态B燃烧时生成无毒无害物质,并释放524.5 kJ的热量,试写出该反应的热化学方程式为 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是 (填字母代号)。
A.+99.7 kJ·mol-1 | B.+29.7 kJ·mol-1 | C.-20.6 kJ·mol-1 | D.-241.8 kJ·mol-1 |
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R。写出阳极生成R的电极反应式: 。


 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星. mol的硫
mol的硫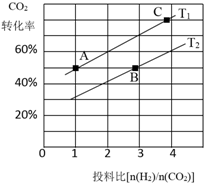 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.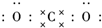 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.