题目内容
11. 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.(1)写出Fe3+的基态核外电子排布式[Ar]3d5.
(2)HCHO分子中碳原子轨道的杂化轨道类型为sp2;1mol HCN分子中含有σ键的数目为2mol.
(3)N2O的空间构型为直线型,与N2O互分等电子体的一种离子为CNO-.
(4)TiO2的天然晶体中,最稳定的一种晶体结构如图,则黑球表示钛(Ti)原子.
分析 (1)铁是26号元素,铁原子核外有26个电子,铁原子失去3个电子变为Fe3+,根据构造原理写出Fe3+基态离子核外电子排布式;
(2)根据碳原子成的σ键、孤电子对数目确定杂化轨道数目,进而确定C原子杂化方式;单键都是σ键,双键和三键都是只有一个σ键;
(3)原子数相同,电子总数相同的分子,互称为等电子体,等电子体的结构相似,据此分析;
(4)根据均摊法计算出验原子数目.
解答 解:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去3个电子变为Fe3+,根据构造原理知,该离子核外电子排布式为[Ar]3d5,
故答案为:[Ar]3d5;
(2)HCHO分子,C原子成3个σ键键、没有孤电子对,杂化轨道数目为3,故其杂化类型为sp2杂化;
单键都是σ键,双键和三键都是只有一个σ键,HCN中含有1个H-C键,1个C≡N键,故共有2个σ键,所以1mol HCN中含有的σ键的数目为2mol;
故答案为:sp2;2;
(3)将2个N原子换成CO,所以与N2O互分等电子体的一种分子为CO2,又等电子体的结构相似,所以N2O的空间构型为直线型;将N原子电子数减1得C原子,所以与N2O互分等电子体的一种离子为CNO-,故答案为:直线型;CNO-;
(4)黑球的数目=8×$\frac{1}{8}$+1=2,白球数目=4×$\frac{1}{2}$=4,黑白球比例为1:2,故黑球是Ti,
故答案为:钛(Ti).
点评 本题考查较综合,涉及核外电子排布式的书写、等电子体、杂化轨道类型、σ键数的判断等知识点,题目难度中等.注意基础知识的积累.

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
1.在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L.若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件应是( )
| A. | 大于0.6mol | B. | 大于零 | C. | 等于1mol | D. | 任意值 |
6.相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是( )
| A. | 1:2:3 | B. | 23:12:9 | C. | 9:12:23 | D. | 36:69:92 |
 .
.
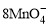 +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O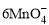 +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O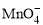 +______Fe2++______H+ =______Mn2++______Fe3++___
+______Fe2++______H+ =______Mn2++______Fe3++___ ___H2O
___H2O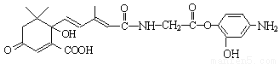 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH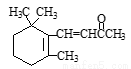 )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物