题目内容
6.在Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2的反应中,则下列叙述正确的是( )| A. | Fe3O4是还原剂 | B. | CO是氧化剂 | ||
| C. | 1mol Fe3O4得到6mol电子 | D. | 4molCO失去8mol电子 |
分析 Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2中,Fe元素的化合价由+$\frac{8}{3}$降低0价,C元素的化合价由+2升高到+4,以此来解答.
解答 解:A.Fe3O4中Fe元素的化合价降低,做氧化剂,故A错误;
B.CO中C元素的化合价升高,则CO为还原剂,故B错误;
C.Fe元素的化合价由+$\frac{8}{3}$降低0价,所以1molFe3O4得到8mol电子,故C错误;
D.C元素的化合价由+2升高到+4,所以4molCO失去8mol电子,故D正确.
故选D.
点评 本题考查氧化还原反应,把握元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化剂的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
| A. | 干燥的 | B. | 不漏水的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 标有刻度的 |
1.在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L.若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件应是( )
| A. | 大于0.6mol | B. | 大于零 | C. | 等于1mol | D. | 任意值 |
11.下列操作不能达成实验目的是( )
| A. | 溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br- | |
| B. | 用电石和饱和食盐水制取乙炔 | |
| C. | 用苯、12mol/L的硝酸和18mol/L的硫酸制硝基苯 | |
| D. | 用稀硝酸洗涤做过银镜反应的试管 |
18.下列有关离子的检验,正确的是( )
| A. | 某化合物焰色反应呈黄色,说明该物质中一定含有Na+ | |
| B. | 向某溶液中加入盐酸有气泡产生,说明一定有CO32- | |
| C. | 向某溶液中加入氯化钡溶液,有白色沉淀产生,说明一定有SO42- | |
| D. | 向某溶液中加入硝酸银溶液,有白色沉淀产生,说明一定有Cl- |
15.汽车尾气处理装置中发生如下反应,2NO+2CO═N2+2CO2,下列说法正确的是( )
| A. | NO是氧化剂 | B. | CO发生还原反应 | ||
| C. | NO失去电子 | D. | 该反应是复分解反应 |
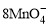 +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O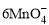 +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O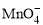 +______Fe2++______H+ =______Mn2++______Fe3++___
+______Fe2++______H+ =______Mn2++______Fe3++___ ___H2O
___H2O