题目内容
5.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| B. | 1mol Na218O2中所含的中子数为42NA | |
| C. | 28g铁粉与足量稀硝酸反应,转移的电子数为NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
分析 A.硫酸和磷酸摩尔质量都是98g/mol,每个分子都含有4个氧原子;
B.1mol过氧化钠含有44molmol中子;
C.铁与足量稀硝酸反应生成硝酸铁;
D.1个环己烷含有12个C-H、6个C-C,共有18个共价键;
解答 解:A.9.8g由H2SO4和H3PO4组成的混合物物质的量为$\frac{9.8g}{98g/mol}$=0.1mol,含有氧原子数为:0.1mol×4×NA=0.4NA,故A正确;
B.1mol Na218O2中所含的中子数为44NA,故B错误;
C.28g铁粉物质的量为:$\frac{28g}{56g/mol}$=0.5mol,与足量稀硝酸反应反应生成0.5mol三价铁离子,转移1.5NA个电子,故C错误;
D.1mol环己烷中含有的共价键数为18NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意环己烷结构特点,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
16.下列实验装置(固定装置略去)和操作正确的是( )
| A. |  除去CO中的CO2 | B. |  酸碱中和滴定 | ||
| C. |  中和热测定 | D. |  实验室制取乙酸乙酯 |
13.下列各组离子在指定溶液中,可能大量共存的是( )
| A. | 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br- | |
| B. | 水电离出的c(H+)=10-13mol•L-1的溶液中:Fe3+、K+、CO32-、SO32- | |
| C. | 室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中:Al3+、Na+、SiO32-、HCO3- | |
| D. | 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42- |
10.下列离子方程式书写正确的是( )
| A. | NaHCO3溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 用食醋除去热水瓶水垢中CaCO3:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向氢氧化钡溶液中滴加足量稀硫酸:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
17.下列属于碱的是( )
| A. | SO2 | B. | H2SiO3 | C. | Na2CO3 | D. | NaOH |
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 25℃、l0IKPa下,NA个C18O2分子的质量为48g | |
| B. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| C. | 1mol白磷(P4)分子中所含化学键的数目为4NA | |
| D. | 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA |
2.下列颜色变化与氧化还原反应有关的是( )
| A. | 将SO2通入品红溶液中,溶液的红色褪去 | |
| B. | 将5滴氯化铁饱和溶液滴入25mL煮沸的蒸馏水中继续加热,液体变红褐色 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 将葡萄糖溶液加入新制Cu(OH)2悬浊液加热至沸腾,出现砖红色沉淀 |
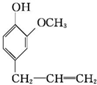 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: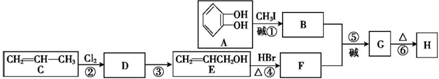
 (X代表卤素原子);
(X代表卤素原子);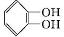 +CH3I$\stackrel{碱}{→}$
+CH3I$\stackrel{碱}{→}$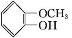 +HI.
+HI.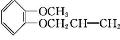 .
.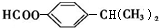 (任写一种).
(任写一种).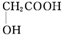 )及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯:
)及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯: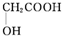 $\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$
$\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$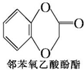
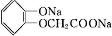 .
.