题目内容
2.下列颜色变化与氧化还原反应有关的是( )| A. | 将SO2通入品红溶液中,溶液的红色褪去 | |
| B. | 将5滴氯化铁饱和溶液滴入25mL煮沸的蒸馏水中继续加热,液体变红褐色 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 将葡萄糖溶液加入新制Cu(OH)2悬浊液加热至沸腾,出现砖红色沉淀 |
分析 A.SO2通入品红溶液中发生化合反应使溶液的红色褪去;
B.铁离子水解生成胶体;
C.向Fe2(SO4)3溶液中滴加NaOH溶液生成红褐色氢氧化铁;
D.葡萄糖含-CHO,具有还原性.
解答 解:A.SO2通入品红溶液中发生化合反应使溶液的红色褪去,没有发生化合价变化,与氧化还原反应无关,故A不选;
B.铁离子水解生成胶体,变成红褐色胶体,与氧化还原反应无关,故B不选;
C.向Fe2(SO4)3溶液中滴加NaOH溶液发生复分解反应生成红褐色氢氧化铁沉淀,与氧化还原反应无关,故C不选;
D.葡萄糖含-CHO,具有还原性,则加入新制Cu(OH)2悬浊液中并加热至沸腾,发生氧化还原反应生成砖红色的氧化亚铜沉淀,与氧化还原反应有关,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意现象与反应的判断,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
5.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| B. | 1mol Na218O2中所含的中子数为42NA | |
| C. | 28g铁粉与足量稀硝酸反应,转移的电子数为NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
6.下列物质的性质与用途具有对应关系的是( )
| A. | 二氧化硅熔点高,可用作光导纤维 | |
| B. | 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂 | |
| C. | 明矾易溶于水,可用作净水剂 | |
| D. | 二氧化硫有氧化性,可用于漂白纸张 |
10.下列对Na2O和Na2O2的叙述中正确的是( )
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
7.若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了( )
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
14. 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成Cu而使Cu2O产率降低.
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=-(a+b-2c)kJ•mol-1.
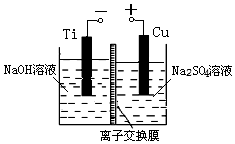
(3)方法Ⅱ通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示.
①阴极上的还原产物是H2.
②已知阳极生成Cu2O,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③Na2SO4溶液的主要作用是增强溶液的导电性.
(4)方法Ⅲ是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(5)肼又称联氨,请写出肼的电子式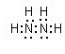 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(7)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,电池工作一段时间后,电解质溶液的pH将减小(填“增大”、“减小”、“不变”).
 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=-(a+b-2c)kJ•mol-1.
(3)方法Ⅱ通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示.
①阴极上的还原产物是H2.
②已知阳极生成Cu2O,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③Na2SO4溶液的主要作用是增强溶液的导电性.
(4)方法Ⅲ是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(5)肼又称联氨,请写出肼的电子式
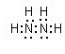 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(7)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,电池工作一段时间后,电解质溶液的pH将减小(填“增大”、“减小”、“不变”).
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.1g37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78g | |
| C. | 7.8g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24L乙烷含有的共价键数为1.9NA |
14.一定温度下,体积均为0.25L的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,达到平衡.下列说法正确的是( )
| 容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| N2 | H2 | NH3 | NH3 | ||
| ① | 500 | 1 | 3 | 0 | 0.5 |
| ② | 500 | 0.6 | 1.8 | 0 | |
| ③ | 550 | 0 | 0 | 2 | a |
| A. | 容器①、②中反应的平衡常数不相等 | |
| B. | 达平衡时,容器②中H2的转化率大于25% | |
| C. | a<0.5 | |
| D. | 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行 |