题目内容
15.丁子香酚H(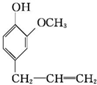 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: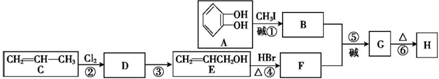
已知:
①
 (X代表卤素原子);
(X代表卤素原子);②A与B相对分子质量之差为14;E与F相对分子质量之差为63;
③E不能发生银镜反应,能与溴水、金属钠反应;
④碳碳双键上不能连羟基;
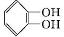
⑤丁子香酚H由它的同分异构体G重排制得.
回答下列问题:
(1)A的官能团名称为羟基;A生成B的化学方程式为
 +CH3I$\stackrel{碱}{→}$
+CH3I$\stackrel{碱}{→}$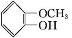 +HI.
+HI.(2)C生成D的化学方程式为CH2=CHCH3+Cl2$\stackrel{光照}{→}$CH2=CHCH2Cl+HCl;反应类型为取代反应.
(3)G的结构简式为
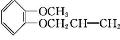 .
.(4)写出与丁子香酚互为同分异构体且满足下列条件的结构简式:
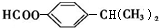 (任写一种).
(任写一种).①属于芳香族化合物 ②核磁共振氢谱有5组峰,且峰面积比为6:2:2:1:1 ③能发生银镜反应和水解反应
(5)以羟基乙酸(
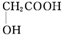 )及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯:
)及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯: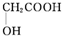 $\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$
$\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$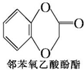
反应条件Ⅰ所选择的试剂为HBr(或HCl);反应条件Ⅱ所选择的试剂为浓硫酸,H的结构简式为
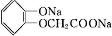 .
.
分析 由E的结构简式可知,丙烯与氯气发生取代反应生成D为CH2=CHCH2Cl,D在氢氧化钠水溶液、加热条件下发生水解反应得到E,E与F相对分子质量之差为63,E与HBr发生取代反应生成F为CH2=CHCH2Br.A与B相对分子质量之差为14,A发生取代反应生成B为 ,B与F发生信息中取代反应生成G为
,B与F发生信息中取代反应生成G为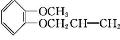 ,G重排得到H,以此解答该题.
,G重排得到H,以此解答该题.
解答 解:(1)A为 ,含有羟基,A发生取代反应生成B为
,含有羟基,A发生取代反应生成B为 ,方程式为
,方程式为 +CH3I$\stackrel{碱}{→}$
+CH3I$\stackrel{碱}{→}$ +HI,
+HI,
故答案为:羟基; +CH3I$\stackrel{碱}{→}$
+CH3I$\stackrel{碱}{→}$ +HI;
+HI;
(2)C与氯气发生取代反应生成D为CH2=CHCH2Cl,方程式为CH2CHCH2OH+HBr$\stackrel{△}{→}$CH2CHCH2Br+H2O,
故答案为:CH2=CHCH3+Cl2$\stackrel{光照}{→}$CH2=CHCH2Cl+HCl;取代反应;
(3)由以上分析可知G为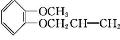 ,故答案为:
,故答案为: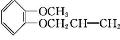 ;
;
(4)与丁子香酚互为同分异构体且满足下列条件:
①属于芳香族化合物,说明含有苯环,③能发生银镜反应和水解反应,含有甲酸形成的酯基,②核磁共振氢谱有5组峰,且峰面积比为6:2:2:1:1,可以含有2个取代基-OOCH、-CH(CH3)2且处于对位,同分异构体的结构简式为: ,
,
故答案为: ;
;
(5)由流程可知羟基乙酸与HBr或HCl发生取代反应生成ClCH2COOH或BrCH2COOH,然后与 在碱性条件下发生反应生成
在碱性条件下发生反应生成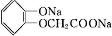 ,酸化后在浓硫酸作用下可生成
,酸化后在浓硫酸作用下可生成 ,
,
故答案为:HBr(或HCl);浓硫酸;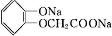 .
.
点评 本题考查有机物的推断与性质,涉及有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,难度不大.

练习册系列答案
相关题目
11.化学与生产、生活、科技等密切相关,下列说法不正确的是( )
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 |
12.X、Y、Z、W为原子序数依次增大的短周期主族元素,Y与W同主族.物质A、B、C均由其中三种元素组成,且为中学常见强电解质,可发生反应A+2B═C+2H2O.下列推断正确的是( )
| A. | Y与Z位于同一周期 | B. | 单质氧化性:Y<W | ||
| C. | W的氢化物具强还原性 | D. | lmol C中含有离子数目为2NA |
3.有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐.运用该原理生产铜和绿矾(FeSO4•7H2O)的流程如图:
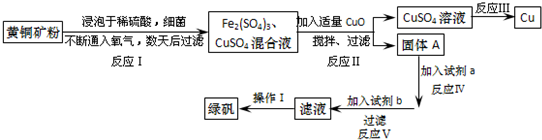
回答下列问题:
(1)已知:
加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因Fe3+在溶液中存在存在平衡Fe3++3H2O?Fe(OH)3+3H+,加入CuO消耗溶液中的H+,使c(H+)减小,使Fe3+转化为Fe(OH)3沉淀而除去,不损耗铜离子且不引入杂质.
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.

回答下列问题:
(1)已知:
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.
10.在一定条件下,将A和B各0.32mol充入10L恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H<0,反应过程中测定的数据如表,下列说法正确的是( )
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 反应前2 min的平均速率v(C)=0.004 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol | |
| D. | 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大 |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 常温下加水稀释时c(H+)/c(OH-)明显增大的溶液:CH3COO-、Ba2+、NO3-、Br- | |
| B. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Na+、Cl-、CO32-、NO3- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
7.新制氢氧化铜存在平衡:Cu(OH)2+2OH-?Cu(OH)42-(深蓝色).某同学进行下列实验:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | ①中出现蓝色沉淀 | |
| B. | ③中现象是Cu(OH)2+2OH-?Cu(OH)42-正向移动的结果 | |
| C. | ④中现象证明葡萄糖具有还原性 | |
| D. | 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42- |
5.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| B. | 1mol Na218O2中所含的中子数为42NA | |
| C. | 28g铁粉与足量稀硝酸反应,转移的电子数为NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |