题目内容
13.下列各组离子在指定溶液中,可能大量共存的是( )| A. | 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br- | |
| B. | 水电离出的c(H+)=10-13mol•L-1的溶液中:Fe3+、K+、CO32-、SO32- | |
| C. | 室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中:Al3+、Na+、SiO32-、HCO3- | |
| D. | 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42- |
分析 A.加入铝能放出H2的溶液,为非氧化性酸或强碱溶液;
B.水电离出的c(H+)=10-13mol•L-1的溶液,为酸或碱溶液;
C.室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液,显碱性;
D.使石蕊变红的溶液,显酸性.
解答 解:A.加入铝能放出H2的溶液,为非氧化性酸或强碱溶液,酸溶液中该组离子之间不反应,可大量共存,故A选;
B.水电离出的c(H+)=10-13mol•L-1的溶液,为酸或碱溶液,碱溶液不能大量存在Fe3+,酸溶液中不能存在CO32-、SO32-,故B不选;
C.室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液,显碱性,不能大量存在Al3+、HCO3-,且相互促进水解不能共存,故C不选;
D.使石蕊变红的溶液,显酸性,Fe2+、H+、ClO-发生氧化还原反应,不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
3.有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐.运用该原理生产铜和绿矾(FeSO4•7H2O)的流程如图:
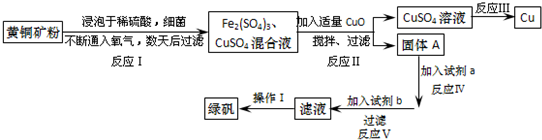
回答下列问题:
(1)已知:
加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因Fe3+在溶液中存在存在平衡Fe3++3H2O?Fe(OH)3+3H+,加入CuO消耗溶液中的H+,使c(H+)减小,使Fe3+转化为Fe(OH)3沉淀而除去,不损耗铜离子且不引入杂质.
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.

回答下列问题:
(1)已知:
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.
18.短周期元素W、X、Y和Z的原子序数依次增大.元素W是形成化合物数量众多,且分布极广的元素,X原子的最外层电子数是其电子层数的3倍,元素Y是地壳中含量最丰富的金属元素,Z元素的单质易溶于WZ2中.下列说法错误的是( )
| A. | 元素X、Y与Z的原子半径大小:Y>Z>X | |
| B. | 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子 | |
| C. | 元素X与元素Y形成的化合物是一种较好的耐火材料 | |
| D. | 元素X可与元素Z可组成3种二价阴离子 |
5.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| B. | 1mol Na218O2中所含的中子数为42NA | |
| C. | 28g铁粉与足量稀硝酸反应,转移的电子数为NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
2.下列说法正确的是( )
| A. | 用分液的方法可以分离汽油和水 | |
| B. | 酒精灯加热试管时须垫石棉网 | |
| C. | NH3能使湿润的蓝色石蕊试纸变红 | |
| D. | 盛放NaOH溶液的广口瓶,可用玻璃塞 |
10.下列对Na2O和Na2O2的叙述中正确的是( )
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |


 .
.