题目内容
17.下列属于碱的是( )| A. | SO2 | B. | H2SiO3 | C. | Na2CO3 | D. | NaOH |
分析 碱是指在电离时产生的阴离子全部是氢氧根离子的化合物,据此进行分析判断.
解答 解:A.二氧化硫是由氧元素和硫元素组成的氧化物,故A错误;
B.H2SiO3电离出的阴离子是硅酸根离子,属于酸,故B错误;
C.Na2CO3电离出的阴离子是碳酸根离子,属于盐,故C错误;
D.氢氧化钠电离方程式为:NaOH=Na++OH-,阴离子全部是氢氧根离子,属于碱,故D正确;
故选D.
点评 本题考查碱的判别,掌握物质类别的分类标准,抓住氧化物、酸、碱、盐的特征、熟悉常见的物质的组成是正确解答本题的关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.新制氢氧化铜存在平衡:Cu(OH)2+2OH-?Cu(OH)42-(深蓝色).某同学进行下列实验:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | ①中出现蓝色沉淀 | |
| B. | ③中现象是Cu(OH)2+2OH-?Cu(OH)42-正向移动的结果 | |
| C. | ④中现象证明葡萄糖具有还原性 | |
| D. | 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42- |
5.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| B. | 1mol Na218O2中所含的中子数为42NA | |
| C. | 28g铁粉与足量稀硝酸反应,转移的电子数为NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
12.图分别代表NaCl、金刚石、干冰、石墨结构的一部分.下列说法正确的是( )
| A. |  如图,NaCl晶体只有在熔融状态下离子键被完全破坏,才能形成自由移动的离子 | |
| B. |  如图,金刚石中存在的化学键只有共价键,不能导电 | |
| C. |  如图,干冰中的化学键只需吸收很少的热量就可以破坏,所以干冰容易升华 | |
| D. |  如图,石墨中碳原子的最外层电子都参与了共价键的形成,故熔点很高、硬度很大 |
2.下列说法正确的是( )
| A. | 用分液的方法可以分离汽油和水 | |
| B. | 酒精灯加热试管时须垫石棉网 | |
| C. | NH3能使湿润的蓝色石蕊试纸变红 | |
| D. | 盛放NaOH溶液的广口瓶,可用玻璃塞 |
6.下列物质的性质与用途具有对应关系的是( )
| A. | 二氧化硅熔点高,可用作光导纤维 | |
| B. | 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂 | |
| C. | 明矾易溶于水,可用作净水剂 | |
| D. | 二氧化硫有氧化性,可用于漂白纸张 |
14. 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成Cu而使Cu2O产率降低.
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=-(a+b-2c)kJ•mol-1.
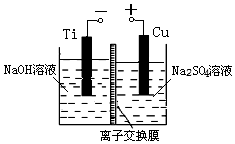
(3)方法Ⅱ通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示.
①阴极上的还原产物是H2.
②已知阳极生成Cu2O,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③Na2SO4溶液的主要作用是增强溶液的导电性.
(4)方法Ⅲ是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(5)肼又称联氨,请写出肼的电子式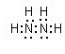 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(7)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,电池工作一段时间后,电解质溶液的pH将减小(填“增大”、“减小”、“不变”).
 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=-(a+b-2c)kJ•mol-1.
(3)方法Ⅱ通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示.
①阴极上的还原产物是H2.
②已知阳极生成Cu2O,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③Na2SO4溶液的主要作用是增强溶液的导电性.
(4)方法Ⅲ是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(5)肼又称联氨,请写出肼的电子式
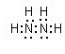 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(7)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,电池工作一段时间后,电解质溶液的pH将减小(填“增大”、“减小”、“不变”).

 .
.