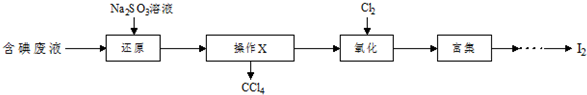
题目内容
19.下列有关金属电化学腐蚀的说法正确的是( )| A. | 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀 | |
| B. | 铁只能发生析氢腐蚀 | |
| C. | 铜只能发生吸氧腐蚀 | |
| D. | 析氢腐蚀比吸氧腐蚀普遍 |
分析 铜活泼性比氢弱,而铁比氢强,所以铜不能发生析氢腐蚀只能发生吸氧腐蚀,铁既可以发生析氢腐蚀也可以发生吸氧腐蚀,据此分析.
解答 解:A.铜活泼性比氢弱,不能发生析氢腐蚀,故A错误;
B.铁活泼性比氢强,所以铁既可以发生析氢腐蚀也可以发生吸氧腐蚀,故B错误;
C.铜活泼性比氢弱,不能发生析氢腐蚀,只能发生吸氧腐蚀,故C正确;
D.吸氧腐蚀比析氢腐蚀普遍,故D错误;
故选:C.
点评 本题考查了金属的腐蚀与防护,注意铜活泼性比氢弱,不能发生析氢腐蚀,题目难度不大.

练习册系列答案
相关题目
15.常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A. | c(ClO-)=1.0mol/L的溶液中:Na+、SO32-、S2-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Ca2+、Mg2+、HCO3-、I- | |
| C. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| D. | 由水电离的c(H+)=1×10-12mol/L的溶液中:Ba2+、K+、Cl-、NO3- |
4.下列关于化学实验的一些说法正确的是( )
| A. | 容量瓶不可以用来溶解固体,但可以用来稀释浓的溶液 | |
| B. | 粗盐提纯时过滤所用普通漏斗与萃取所用分液漏斗结构是一样的 | |
| C. | 用50mL量筒可准确配制50mL0.10mol/L的碳酸钠溶液 | |
| D. | 实验室制蒸馏水时冷凝管要“下进水、上出水”并保还水的持续流动 |
9.下列物质在水中最易电离出氢离子的是( )
| A. | C2H5OH | B. | C6H5OH | C. | H2O | D. | CH3COOH |
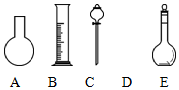 实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题: