题目内容
15.常温下,下列各组离子在制定溶液中一定能大量共存的是( )| A. | c(ClO-)=1.0mol/L的溶液中:Na+、SO32-、S2-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Ca2+、Mg2+、HCO3-、I- | |
| C. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| D. | 由水电离的c(H+)=1×10-12mol/L的溶液中:Ba2+、K+、Cl-、NO3- |
分析 A.离子之间发生氧化还原反应;
B.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液,显碱性;
C.滴入少量KSCN溶液显红色的溶液,含铁离子;
D.由水电离的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液.
解答 解:A.ClO-分别与SO32-、S2-发生氧化还原反应,不能共存,故A不选;
B.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液,显碱性,不能大量存在Mg2+、HCO3-,故B不选;
C.滴入少量KSCN溶液显红色的溶液,含铁离子,与I-发生氧化还原反应,不能共存,故C不选;
D.由水电离的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液,酸碱溶液中该组离子之间均不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
6. 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )| A. | x可能等于2也可能等于3 | |
| B. | 若向平衡后的乙容器中充入C,则再次达到平衡时A 的体积分数不变 | |
| C. | 单独升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同 | |
| D. | 若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol•L-1<c(A)<0.5mol•L-1 |
3.下列叙述中正确的是( )
| A. | 金属的熔点和沸点都很高 | B. | CCl4是含有极性键的非极性分子 | ||
| C. | HF、HCl、HBr、HI的稳定性依次增强 | D. | 第一电离能N<O |
10. 如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )
如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )
 如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )
如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )| A. | 通入H2的电极为负极,A为NH4Cl | |
| B. | 每转移0.1mol电子,消耗1.12L H2 | |
| C. | 溶液中H+向通入N2的一极移动,Cl-向通入H2的一极移动 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+═2NH4+ |
20.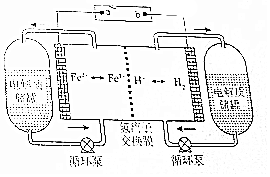 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
2.在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体.
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
(4)某同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{a-\frac{84b}{31}}{a}$(用含a、b的代数式表示)
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液,振荡,观察 | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸,再加入少许AgNO3溶液振荡,观察 | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{a-\frac{84b}{31}}{a}$(用含a、b的代数式表示)
19.下列有关金属电化学腐蚀的说法正确的是( )
| A. | 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀 | |
| B. | 铁只能发生析氢腐蚀 | |
| C. | 铜只能发生吸氧腐蚀 | |
| D. | 析氢腐蚀比吸氧腐蚀普遍 |
20.列反应的离子方程式正确的是( )
| A. | 用铂作电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 以铜做电极电解硫酸铜溶液:2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$4H++2Cu+O2↑ | |
| C. | 甲烷/KOH燃料电池正极反应:O2+4H++4e-═2H2O | |
| D. | 高铁电池 3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3-3e-+5 OH-═FeO42-+4H2O |
 .
.