题目内容
14.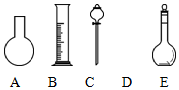 实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是AC(填序号),配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)容量瓶所不具备的功能有CDE(填序号).
A.配制一定体积准确浓度的标准溶液
B.使用移液管或滴定管量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.贮存溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为16.0g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度等于0.80mol•L-1(填“大于”“等于”或“小于”,下同).若还未等溶液冷却就定容了,则所得溶液浓度大于0.80mol•L-1.
(4)试通过计算,所需质量分数为98%、密度为1.84g•cm-3的浓硫酸的体积为10.9mL (计算结果保留一位小数).
(5)准确称量二水合草酸晶体(H2C2O4•2H2O)mg于锥形瓶中,加适量蒸馏水溶解,滴加2滴酚酞指示剂,用未知浓度的NaOH溶液滴定到终点,终点的颜色变化是无色变成粉红色且半分钟不褪色写出滴定反应的离子方程式:H2C2O4+2OH-=C2O42-+2H2O通过这种滴定方法,可以准确标定出NaOH溶液的浓度,假设消耗NaOH溶液的体积为VmL,列出计算NaOH准确浓度的式子:$\frac{1000m}{63V}$.
分析 (1)根据配制一定物质的量浓度的溶液的步骤确定所用仪器进行判断;
(2)容量瓶为配制特定体积溶液的专用仪器,不能稀释浓溶液、不能用于溶解固体、储存溶液等;
(3)依据m=CVM计算需要氢氧化钠的质量;分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)依据c=$\frac{1000ρω}{M}$计算质量分数为98%、密度为1.84g•cm-3的浓硫酸物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
(5)草酸与氢氧化钠反应生成草酸钠和水,氢氧化钠滴定草酸,可以选择酚酞做指示剂,酚酞遇到碱显粉红色,据此判断终点;依据方程式中草酸与氢氧化钠物质的量计算氢氧化钠浓度.
解答 解:(1)配制一定物质的量浓度的溶液需要的仪器有:托盘天平、量筒、药匙、烧杯、玻璃杯、500ml的容量瓶、胶头滴管,不需要的是圆底烧瓶、分液漏斗;
故答案为:A、C;烧杯、玻璃棒;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,故选CDE;
故答案为:CDE;
(3)需要0.80mol•L-1 NaOH溶液475mL,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.80mol/L×40g/mol×0.5L=16.0g;
在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,所以所得溶液浓度等于0.80mol•L-1;
若还未等溶液冷却就定容了,冷却后,液面下降,溶液体积偏小,溶液浓度偏大,所以所得溶液浓度 大于.80mol•L-1;
故答案为:16.0 等于 大于;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为c(浓硫酸)=$\frac{1000×1.84×98%}{98}$=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.4mol/L×0.5L,得V=0.0109L=10.9mL,
故答案为:10.9;
(5)草酸与氢氧化钠反应生成草酸钠和水,离子方程式:H2 C2O4+2OH-=C2O42-+2H2O,氢氧化钠滴定草酸,可以选择酚酞做指示剂,用未知浓度的NaOH溶液滴定到终点,终点的颜色变化是无色变成粉红色且半分钟不褪色;依据方程式可知:
H2 C2O4+2OH-=C2O42-+2H2O,
1 2
$\frac{m}{126}$ c(NaOH)×V×10-3
则:1×c(NaOH)×V×10-3=2×$\frac{m}{126}$,解得c(NaOH)=$\frac{1000m}{63V}$(mol/L)
故答案为:酚酞; 无色变成粉红色且半分钟不褪色; H2 C2O4+2OH-=C2O42-+2H2O;$\frac{1000m}{63V}$;
点评 本题主要考查一定物质的量浓度溶液的配制与稀释,有关物质的量浓度计算,中和滴定实验,明确配制原理及中和滴定原理是解题关键,题目难度中等.

| A. | 加碘盐的溶液遇淀粉变蓝 | |
| B. | 汽油和柴油均为石油分馏得到的产品 | |
| C. | CaCO3可用作工业废气的脱硫剂 | |
| D. | 蔗糖、淀粉、蛋白质溶于水均能形成胶体 |
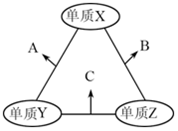 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |
| A. | 胆固醇: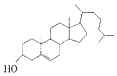 | B. | 芬必得: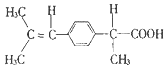 | ||
| C. | 保幼激素JH-I: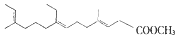 | D. | 维生素C: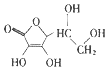 |
| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )| A. | x可能等于2也可能等于3 | |
| B. | 若向平衡后的乙容器中充入C,则再次达到平衡时A 的体积分数不变 | |
| C. | 单独升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同 | |
| D. | 若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol•L-1<c(A)<0.5mol•L-1 |
| A. | 金属的熔点和沸点都很高 | B. | CCl4是含有极性键的非极性分子 | ||
| C. | HF、HCl、HBr、HI的稳定性依次增强 | D. | 第一电离能N<O |
| A. | 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀 | |
| B. | 铁只能发生析氢腐蚀 | |
| C. | 铜只能发生吸氧腐蚀 | |
| D. | 析氢腐蚀比吸氧腐蚀普遍 |
 .
.