题目内容
4.下列关于化学实验的一些说法正确的是( )| A. | 容量瓶不可以用来溶解固体,但可以用来稀释浓的溶液 | |
| B. | 粗盐提纯时过滤所用普通漏斗与萃取所用分液漏斗结构是一样的 | |
| C. | 用50mL量筒可准确配制50mL0.10mol/L的碳酸钠溶液 | |
| D. | 实验室制蒸馏水时冷凝管要“下进水、上出水”并保还水的持续流动 |
分析 A.容量瓶不能用于稀释溶液;
B.过滤用普通漏斗;
C.量筒不能用于配制溶液;
D.蒸馏时,冷凝水应充满冷凝管.
解答 解:A.容量瓶只能用于配制一定浓度的溶液,不能用于稀释溶液,故A错误;
B.过滤用普通漏斗,与分液漏斗不同,故B错误;
C.量筒不能用于配制溶液,应在容量瓶中配制,故C错误;
D.蒸馏时,冷凝水应充满冷凝管,则冷凝管要“下进水、上出水”并保还水的持续流动,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的配制、分离等操作,为高频考点,侧重考查学生的分析能力和实验能力,注意把握操作的可行性的评价,难度不大.

练习册系列答案
相关题目
19.下列离子方程式的书写与所给条件不相符的是( )
| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
20.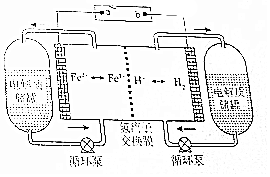 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
12.为吸收多余的氯气,防止污染环境,下列试剂中最合适的是( )
| A. | 烧碱溶液 | B. | 饱和石灰水 | C. | 自来水 | D. | 食盐水 |
19.下列有关金属电化学腐蚀的说法正确的是( )
| A. | 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀 | |
| B. | 铁只能发生析氢腐蚀 | |
| C. | 铜只能发生吸氧腐蚀 | |
| D. | 析氢腐蚀比吸氧腐蚀普遍 |
9.某温度下,某碳酸钠饱和溶液质量分数为a%,;若分别向其中加入m molNa2CO3•5H2O和n mol Na2CO3,可析出相同质量的晶体Na2CO3•10H2O.则下列叙述正确的是( )
| A. | a可能是40,m>n | B. | a可能是40,m=n | C. | a可能是30,m>n | D. | a可能是30,m<n |
16.可逆反应:3A(g)?3B(?)+C(?);△H>0,升高温度,气体的平均相对分子质量变小,则下列判断正确的是( )
| A. | B和C一定都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C不可能都是气体 |
13.已知还原性:SO32->I-.向含有a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应).下列说法错误的是( )
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |