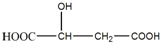
题目内容
1.按要求回答下列问题:(1)O4是意大利的一位科学家合成的一种新型氧分子,一个分子由四个氧原子构成,在相同条件下,等质量的O4和O3氧原子数之比为1:1;两种气体的体积之比为3:4.
(2)氯元素是生产生活中常见的非金属元素.将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式Cl2+2OH-═Cl-+ClO-+H2O; 使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物.下列物质中可以替代Cl2为自来水杀菌消毒的ad(填字母序号).
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)某同学为检验溶液中是否含Fe2+,做如下实验:取少量溶液于试管中,滴加几滴KSCN溶液,无明显现象;再滴加H2O2,发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生.为弄清其中缘由,他查阅资料知:H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+(SCN-中S为-2价)
①该反应中,被氧化的元素为N、S,每生成lmolCO2转移的电子数为11NA;
②根据该同学的实验现象,请判断还原性强弱为:Fe2+>SCN-(填<、=或>).
分析 (1)等质量的O4和O3,构成元素相同、其摩尔质量相同,所以其原子个数相等;相同条件下,气体摩尔体积相等,根据V=$\frac{m}{M}$Vm知,质量相同、气体摩尔体积相同时,其体积之比等于摩尔质量反比;
(2)Cl2通入NaOH溶液中,反应生成氯化钠、NaClO、水;替代Cl2为自来水杀菌消毒的物质应具有强氧化性;
(3)乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,说明含有Fe2+,不含Fe3+;继续滴加H2O2,红色逐渐褪去且有气泡产生,发生H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+,反应中N、S盐酸化合价升高,被氧化,结合化合价的变化以及物质的性质解答该题.
解答 解:(1)等质量的O4和O3,构成元素相同、其摩尔质量相同,所以其原子个数相等,为1:1;相同条件下,气体摩尔体积相等,根据V=$\frac{m}{M}$Vm知,质量相同、气体摩尔体积相同时,其体积之比等于摩尔质量反比=48g/mol:64g/mol=3:4,
故答案为:1:1;3:4;
(2)氯气与氢氧化钠反应生成氯化钠、次氯酸与水,反应离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,替代Cl2为自来水杀菌消毒的物质应具有强氧化性,可以用臭氧、ClO2代替,氨气不能杀菌消毒、硫酸铝可以除去悬浮物质,不能杀菌消毒,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;ad;
(3)①乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,说明含有Fe2+,不含Fe3+;继续滴加H2O2,红色逐渐褪去且有气泡产生,发生H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+,反应中N、S盐酸化合价升高,S元素化合价有-2价升高到+6价,N元素化合价由-3价升高到0价,被氧化,每生成lmol CO2,有方程式可知生成1molSO42-,0.5mol+N2,转移的电子的物质的量为1mol×8+0.5mol×2×3=11mol,为11NA个,
故答案为:N、S;11;
②由反应的先后顺序可知过氧化氢先氧化Fe2+,则Fe2+还原性较强,
故答案为:>.
点评 本题综合考查物质的量的计算以及氧化还原反应等知识,为高频考点,题目难度中等,注意掌握离子反应发生条件,明确常见离子的检验方法,试题培养了学生的分析、理解能力及逻辑推理能力.

| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 | 加热前D的试管中闻 到特殊香味,加热后只有C仍有分层现象 |
A乙醇,B乙酸,C苯,D乙酸乙酯,E油脂,F葡萄糖溶液,G蔗糖溶液.
| A. | 向Na2SiO3溶液中加入稀盐酸 | |
| B. | 将CO2通入CaCl2溶液中 | |
| C. | 向FeCl2溶液中加入过量NaOH溶液 | |
| D. | 向Al2(SO4)3溶液中加入过量NaOH溶液 |
| A. | 相同条件下,硅甲烷的密度小于甲烷 | |
| B. | 硅甲烷燃烧生成二氧化硅和水 | |
| C. | 硅烷的分子通式可表示为SinH2n+2 | |
| D. | 硅甲烷与硅乙烷的相对分子质量相差30 |
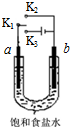 用如图装置研究电化学原理,下列分析中错误的是( )
用如图装置研究电化学原理,下列分析中错误的是( )| 选项 | 连接 | 电极材料 | 分析 | |
| a | b | |||
| A | K1 K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
| B | K1 K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
| C | K1 K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
| D | K1 K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
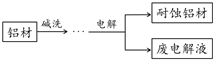 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )| A. | 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3═2AlO2-+H2O | |
| B. | 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 获得耐蚀铝材的电极反应为:4Al-12e-+3O2═2Al2O3 | |
| D. | 用稀氨水洗去耐蚀铝材表面的酸:NH3•H2O+H+═NH4++H2O |
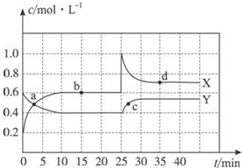 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图.