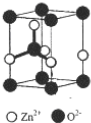
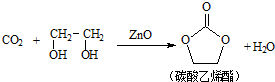题目内容
1. X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | E与G的原子序数相差25 | |
| B. | 常温下,X和Y的单质均能与水剧烈反应 | |
| C. | TE2的熔点高于ZE2晶体 | |
| D. | E、T、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
分析 T的最高价氧化物对水化物有强脱水性,则T为S元素,由位置关系可知E为O元素、Z为Si、G为As,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数,则Y为Mg,可推知X为Be.
A.第四周期VIA族元素原子序数与O元素原子序数之差为8+18=26;
B.Mg与冷水发生微弱反应;
C.SO2属于分子晶体,而SiO2属于原子晶体;
D.同周期自左而右原子半径减小、非金属性增强,同主族自上而下原子半径增大、非金属性减弱,非金属性越强,对应氢化物越稳定.
解答 解:T的最高价氧化物对水化物有强脱水性,则T为S元素,由位置关系可知E为O元素、Z为Si、G为As,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数,则Y为Mg,可推知X为Be.
A.第四周期VIA族元素原子序数与O元素原子序数之差为8+18=26,则E与G的原子序数相差26-1=25,故A正确;
B.Mg与冷水发生微弱反应,Be与冷水几乎不反应,故B错误;
C.SO2属于分子晶体,而SiO2属于原子晶体,故SiO2的熔点更高,故C错误;
D.同周期自左而右原子半径减小、非金属性增强,同主族自上而下原子半径增大、非金属性减弱,故原子半径E<T<Z,非金属性Z<T<E,非金属性越强,对应氢化物越稳定,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解同主族元素原子序数关系,掌握元素周期律.

练习册系列答案
相关题目
6.如图,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )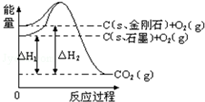

| A. | 金刚石的稳定性强于石墨 | |
| B. | 12g石墨总键能比12g金刚石小1.9kJ | |
| C. | 石墨和金刚石的转化是物理变化 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol |
7.用NA 表示阿伏加德罗常数的值( )
| A. | 0.2molNa2O2 完全与水反应转移的电子数为0.4NA | |
| B. | 800mL 2mol•L-1酒精溶液中所含分子数为0.6NA | |
| C. | 常温常压下,1.6g O2和O3的混合气体所含电子书为0.8NA | |
| D. | 在常温常压下,2.24L NO2与O2混合气体中所含氧原子数为0.2NA |
9.氯气及其化合物在生产和生活中有重要应用,下列关于氯及其化合物的说法正确的是( )
| A. | NaClO是“84消毒液”的有效成分,其水溶液能使有色布条褪色,反应中NaClO表现还原性 | |
| B. | Cl2与烧碱溶液反应的实质是Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 氯气有毒,在通风橱中制备氯气可以消除氯气的污染 | |
| D. | 将Cl2通入淀粉-KI溶液,溶液变蓝色 |
16.下表是元素周期表的一部分:
(1)表中元素②、③、⑨的氢化物的化学式为NH3、H2O、HCl.
(2)某元素的原子结构示意图为: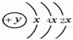 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
(2)某元素的原子结构示意图为:
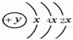 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.
6.如表列出的有关表述中不准确的是( )
| 序号 | A | B | C | D |
| 物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
| 代表物质 | NaCl | 金刚石 | 干冰 | Ne |
| 组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
| 结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
10.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )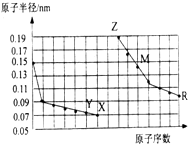

| A. | 简单离子的半径大小比较:Z>Y>X | |
| B. | 气态氢化物稳定性:Y>X>R | |
| C. | 单质的熔点:M>Z | |
| D. | Z单质能从M的盐溶液中置换出单质M |
11.将5g 的CO与H2的混合气体和足量的氧气充分反应后,在150℃时将混合气体通过足量的Na2O2固体,则Na2O2固体增加的质量为( )
| A. | 1.5g | B. | 3g | C. | 5g | D. | 无法确定 |