题目内容
16.下表是元素周期表的一部分:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
(2)某元素的原子结构示意图为:
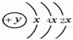 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.
分析 由元素在周期表中位置可知①为H、②为N、③为O、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为S、⑨为Cl.
(1)元素②、③、⑨的氢化物的化学式分别为 NH3、H2O、HCl;
(2)第一电子层容纳2个电子,则x=2,最外层电子数为4,为Si元素,处于周期表中第三周期IVA族;
(3)④、⑥、⑧、⑨的最高价氧化物对应水化物分别为NaOH、Al(OH)3、H2SO4、HClO4,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,氢氧化钠与硫酸反应生成硫酸钠与水,氢氧化铝与高氯酸反应生成高氯酸铝与水.
解答 解:由元素在周期表中位置可知①为H、②为N、③为O、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为S、⑨为Cl.
(1)元素②、③、⑨的氢化物的化学式分别为 NH3、H2O、HCl,故答案为:NH3、H2O、HCl;
(2)第一电子层容纳2个电子,则x=2,最外层电子数为4,有3个电子层,处于周期表中第三周期IVA族,为Si元素,名称为硅,其最高价氧化物的化学式为 SiO2,
故答案为:三、IVA;硅;SiO2;
(3)④、⑥、⑧、⑨的最高价氧化物对应水化物分别为NaOH、Al(OH)3、H2SO4、HClO4,
氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3=AlO2-+2H2O;
氢氧化钠与硫酸反应生成硫酸钠与水,反应离子方程式为:OH-+H+=H2O;
氢氧化铝与高氯酸反应生成高氯酸铝与水,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;OH-+H+=H2O;Al(OH)3+3H+=Al3++3H2O.
点评 本题考查元素周期表、核外电子排布、结构与位置关系、元素化合物性质、常用化学用语,旨在考查学生对基础知识的掌握.

| A. | 42% | B. | 44% | C. | 48.6% | D. | 91.9% |
| A. | 纤维素、聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 用卤水点豆腐与黄河入海口处沙洲的形成,都体现了胶体聚沉的性质 | |
| C. | 用活性炭为有色物质脱色和用漂白粉漂白有色物质,原理相似 | |
| D. | 为增强84消毒液的消毒效果,使用时可加入浓盐酸 |
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物,溶液显中性或碱性 |
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | 因C元素气态氢化物的沸点比D元素气态氢化物高,所以C原子得电子能力大于D原子 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物,溶液显中性或碱性 |
 X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | E与G的原子序数相差25 | |
| B. | 常温下,X和Y的单质均能与水剧烈反应 | |
| C. | TE2的熔点高于ZE2晶体 | |
| D. | E、T、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
| A. | 向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO | |
| B. | 向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO | |
| C. | 氯水呈浅黄绿色,说明氯水中含有Cl2 | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl- |
| A. | 要除去氯化镁酸性溶液里少量的氯化铁,可以选用氢氧化钠 | |
| B. | 镀锡铁表面有划痕是,仍然能阻止铁被氧化 | |
| C. | 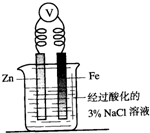 向图烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成 | |
| D. | 各种原生铜的硫化物经氧化、淋滤作用变成硫酸铜,遇到深层的ZnS和PbS,便慢慢地使之转变为CuS |