题目内容
11.将5g 的CO与H2的混合气体和足量的氧气充分反应后,在150℃时将混合气体通过足量的Na2O2固体,则Na2O2固体增加的质量为( )| A. | 1.5g | B. | 3g | C. | 5g | D. | 无法确定 |
分析 CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;
H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量.
解答 解:CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;
H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量,
综上分析,最终固体增重为CO与氢气的总质量,故5gCO和H2的混合气点燃后,再通入足量的Na2O2中,充分反应后,固体增重质量是5g,
故选C.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,难度中等,注意利用差量法从总反应方程式分析固体质量变化是解答该题的关键.

练习册系列答案
相关题目
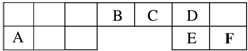
1. X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
 X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | E与G的原子序数相差25 | |
| B. | 常温下,X和Y的单质均能与水剧烈反应 | |
| C. | TE2的熔点高于ZE2晶体 | |
| D. | E、T、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
19.下列关于钠及其化合物的叙述正确的是( )
| A. | 钠长期暴露在空气中的产物是NaHCO3 | |
| B. | 金属钠燃烧时火焰为黄色 | |
| C. | 钠与钠离子都具有强还原性 | |
| D. | 在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2 |
6.下列述叙正确的是( )
| A. | 要除去氯化镁酸性溶液里少量的氯化铁,可以选用氢氧化钠 | |
| B. | 镀锡铁表面有划痕是,仍然能阻止铁被氧化 | |
| C. | 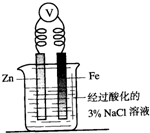 向图烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成 | |
| D. | 各种原生铜的硫化物经氧化、淋滤作用变成硫酸铜,遇到深层的ZnS和PbS,便慢慢地使之转变为CuS |
16.下列物质的提纯方法可能属于化学变化的是( )
| A. | 萃取 | B. | 除杂 | C. | 分液 | D. | 过滤 |
20.某同学设计如下元素周期表,下列说法正确的是( )


| A. | X元素最高价氧化物对应的水化物为弱酸 | |
| B. | Y元素最外层电子数是最内层电子数的2倍 | |
| C. | 原子半径:Y>X>Z | |
| D. | X、Y、Z的气态氢化物中最稳定的是X的氢化物 |
1.下列说法正确的是( )
| A. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| B. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |