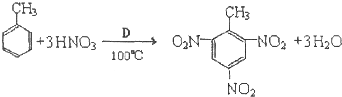
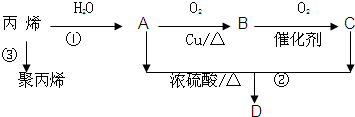
题目内容
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下:| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
(1)写出基态A原子外围电子的电子排布图
(2)E、F两元素的电负性大小比较:E
(3)下列说法正确的是
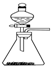
①实验室可用右图所示装置制取B的最高价氧化物.
②用C单质做成的槽车,都可用来运输甲的浓溶液.
③C形成的单质熔点低于D形成的单质的熔点.
④E的氢化物稳定性强于F的氢化物稳定性.
(4)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是
A.漂白剂 B.氧化剂 C.还原剂.
考点:位置结构性质的相互关系应用
专题:
分析:A的最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐,则A为N元素,甲为HNO3、乙为NH3;B原子最外层电子数是次外层电子数的2倍,只能有2个电子层,最外层电子数为4,则B为碳元素;C元素原子M层上有3个电子,则C为Al;D是短周期原子半径最大的主族元素,则D为Na;E的单质是淡黄色固体,则E为硫元素;F元素的最高正价与最低负价代数和为6,处于ⅦA族,则F为Cl,据此解答.
解答:
解:A的最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐,则A为N元素,甲为HNO3、乙为NH3;B原子最外层电子数是次外层电子数的2倍,只能有2个电子层,最外层电子数为4,则B为碳元素;C元素原子M层上有3个电子,则C为Al;D是短周期原子半径最大的主族元素,则D为Na;E的单质是淡黄色固体,则E为硫元素;F元素的最高正价与最低负价代数和为6,处于ⅦA族,则F为Cl,
(1)A为氮元素,原子外围电子的电子排布图为 ,气态氢化物NH3中N原子的价层电子对数为
,气态氢化物NH3中N原子的价层电子对数为
=4,所以N原子杂化类型是SP3
杂化,
故答案为: ;SP3;
;SP3;
(2)E为硫元素、F为氯元素,根据元素周期律,它们的电负性大小比较:S<Cl,
故答案为:<;
(3)①B的最高价氧化物为二氧化碳,可以用碳酸钙与盐酸反应制备,反应为固体与液体反应且不需要加热,可以用图中装置制备,故正确;
②Al在浓硝酸中发生钝化现象,可以用Al单质制成的槽车,可用来运输硝酸浓溶液,故正确;
③Al的熔点高于Na的熔点,故错误;
④硫化氢稳定性弱于氯化氢的稳定性,故错误;
故选①②;
(4)将E的常见氧化物能使品红溶液褪色,该氧化物为二氧化硫,由Cl和Cu的百分含量知,沉淀中只含Cu和Cl两种元素(35.7%+64.3%=100%),且两者的物质的量之比约为
:
=1:1,可知,其化学式为CuCl,其中Cu的化合价为+1价,则原反应物中CuSO4为氧化剂,那可能的还原剂只有SO2,氧化产物是SO42-,
故答案为:C;
(1)A为氮元素,原子外围电子的电子排布图为
 ,气态氢化物NH3中N原子的价层电子对数为
,气态氢化物NH3中N原子的价层电子对数为| 5+3 |
| 2 |
杂化,
故答案为:
 ;SP3;
;SP3; (2)E为硫元素、F为氯元素,根据元素周期律,它们的电负性大小比较:S<Cl,
故答案为:<;
(3)①B的最高价氧化物为二氧化碳,可以用碳酸钙与盐酸反应制备,反应为固体与液体反应且不需要加热,可以用图中装置制备,故正确;
②Al在浓硝酸中发生钝化现象,可以用Al单质制成的槽车,可用来运输硝酸浓溶液,故正确;
③Al的熔点高于Na的熔点,故错误;
④硫化氢稳定性弱于氯化氢的稳定性,故错误;
故选①②;
(4)将E的常见氧化物能使品红溶液褪色,该氧化物为二氧化硫,由Cl和Cu的百分含量知,沉淀中只含Cu和Cl两种元素(35.7%+64.3%=100%),且两者的物质的量之比约为
| 35.7% |
| 35.5 |
| 64.3% |
| 64 |
故答案为:C;
点评:本题考查结构性质位置关系应用,推断元素是解题关键,第(4)问,注意根据元素质量分数确定沉淀的组成,侧重对考查学生分析解决问题的能力,难度中等.

练习册系列答案
相关题目
在溶液中能大量共存,加入OH-有沉淀析出,加入H+有气体放出的是( )
| A、Na+、Cu2+、Cl-、SO42- |
| B、Fe3+、K+、SO42-、NO3- |
| C、Zn2+、Mg2+、HSO3-、SO42- |
| D、Na+、Ca2+、Cl-、HCO3- |
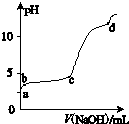 室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )| A、d点时,c(Na+):c (SO42-)=8:3 |
| B、b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| C、a~b段,溶液无沉淀生成,Al3+浓度不变 |
| D、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3 H2O?Al(OH)3+3 OH- |
 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题: