题目内容
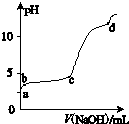 室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )| A、d点时,c(Na+):c (SO42-)=8:3 |
| B、b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| C、a~b段,溶液无沉淀生成,Al3+浓度不变 |
| D、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3 H2O?Al(OH)3+3 OH- |
考点:离子方程式的有关计算
专题:
分析:A.c点后pH发生突变,NaOH过量,但体积未知;
B.b-c段,pH变化不大;
C.a-b段,发生氢离子与碱中和反应,且溶液总体积增大;
D.硫酸铝为强酸弱碱盐,水解显酸性.
B.b-c段,pH变化不大;
C.a-b段,发生氢离子与碱中和反应,且溶液总体积增大;
D.硫酸铝为强酸弱碱盐,水解显酸性.
解答:
解:A.c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,而d点pH>10,NaOH远远过量,但体积未知,溶质为硫酸钠、偏铝酸钠和NaOH,不能计算c(Na+):c (SO42-)的比值,故A错误;
B.b-c段,pH变化不大,主要发生Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀,故B正确;
C.a-b段,发生H++OH-═H2O,但加入NaOH溶液,总体积增大,则Al3+浓度减小,故C错误;
D.硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2O?Al(OH)3+3H+,故D错误;
故选B.
B.b-c段,pH变化不大,主要发生Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀,故B正确;
C.a-b段,发生H++OH-═H2O,但加入NaOH溶液,总体积增大,则Al3+浓度减小,故C错误;
D.硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2O?Al(OH)3+3H+,故D错误;
故选B.
点评:本题为2014年安徽高考化学试题,侧重盐类水解及复分解反应的考查,注意氢氧化铝的两性及图中c点pH突变为解答的关键,明确b→c段中铝离子过量,题目难度不大.

练习册系列答案
相关题目
下列有关叙述正确的是( )
| A、配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水 |
| B、将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液 |
| C、如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗 |
| D、最好用蒸馏的方法分离出CCl4和水的混合物 |
25℃时,下列关于电解质及其溶液的说法,正确的是( )
| A、BaSO4在饱和Na2SO4溶液中的溶解度与Ksp均比在纯水中的小 |
| B、若将0.01molNaOH溶于1L水,则溶液中由水电离产生的c(H+)=1×10-12mol?L-1 |
| C、10ml0.5mol?L-1CH3COONa溶液与6ml1mol?L-1盐酸混合:c(Cl-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| D、pH=4的HA与pH=10的BOH溶液等体积混合,所得溶液pH=7,则HA、BOH一定为强酸和强碱 |
危险化学药品的包装标签上要印有警示性标志,下列物质选用“易燃品”标志的是( )
| A、酒精 | B、烧碱 |
| C、浓硫酸 | D、氯酸钾 |
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下: