题目内容
写出由Zn、O2、NaCl溶液构成的原电池电极反应式 .
考点:电极反应和电池反应方程式
专题:
分析:Zn、碳棒在NaCl溶液中与空气中的氧气形成原电池,发生吸氧腐蚀,负极为锌发生氧化反应,正极为碳棒,发生还原反应.
解答:
解:Zn、碳棒在NaCl溶液中与空气中的氧气形成原电池,发生吸氧腐蚀,负极为锌发生氧化反应,电极反应式为:Zn-2e-=Zn2+;
正极为碳棒,发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-;
故答案为:Zn-2e-=Zn2+;O2+4e-+2H2O=4OH-;
正极为碳棒,发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-;
故答案为:Zn-2e-=Zn2+;O2+4e-+2H2O=4OH-;
点评:本题考查了原电池电极反应式的书写,明确原电池共作原理是解题关键,注意在氯化钠溶液中,锌发生吸氧腐蚀,正极放电物质为氧气,题目难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
将下列各物质分别按等物质的量混合后加水溶解,有沉淀生成的是( )
| A、Na2CO3,NaAlO2,NaOH |
| B、AlCl3,K2SO4,HCl |
| C、CaCl2,Na2CO3,NaOH |
| D、AlCl3,Ba(OH)2,HNO3 |
有M、N两种溶液,各含有下列12种离子中的6种,且所含离子各不相同:Al3+、Na+、K+、Cl-、NO3-、OH-、Fe3+、Ba2+、H+、SO32-、MnO4-、AlO2-.已知每组溶液中的阳离子至少有2种,则下列说法正确的是( )
| A、若溶液M呈强酸性,则N中一定含有OH-、NO3- |
| B、若溶液N呈强酸性,则N中一定含有Al3+、可能含有Na+ |
| C、若溶液N无色,则N中一定不含有Fe3+、Cl-,且溶液M有强氧化性 |
| D、常温下,若M、N两溶液混合后pH=7,则至少生成三种沉淀 |
下列有关叙述正确的是( )
| A、配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水 |
| B、将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液 |
| C、如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗 |
| D、最好用蒸馏的方法分离出CCl4和水的混合物 |
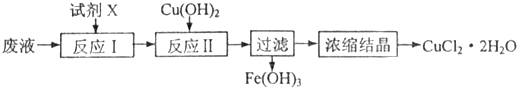
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下: