题目内容
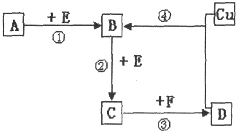 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:(1)若A、B、C、D均为含硫元素的化合物,A是一种常见的矿石的主要成分,且A的摩尔质量为120g.mol-1
①反应①的化学方程式为
②把D和硝酸混合是有机合成中常用的硝化剂,TNT是重要的炸药,广泛应用于民用和国防.它的合成的化学方程式如下:
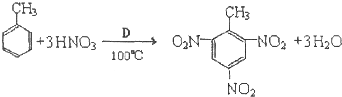
则该反应的有机化学反应类型是
(2)若A、B、C、D均为含氮元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子的结构式为
②反应④的离子方程式为
③取Cu和Cu2O的混合物样品12.0g,加入到足量的D的稀溶液中,用排水法收集产生的气体,标准状况下其体积为2.24L,则样品中Cu2O的质量为
考点:无机物的推断
专题:有机物的化学性质及推断
分析:F在常温下是一种无色液体,D为强酸,则F为H2O,则D为硫酸或硝酸.
(1)若A、B、C、D均为含硫元素的化合物,则D为硫酸,由转化关系可知,B为SO2,C为SO2,E为O2,A是一种常见的矿石的主要成分,且A的摩尔质量为120g?mol-1,则A为FeS2;
(2)若A、B、C、D均为含氮元素的化合物,则D为硝酸,且A的一个分子中只含有10个电子,则A为NH3,B为NO,E为O2,C为NO2,以此来解答.
(1)若A、B、C、D均为含硫元素的化合物,则D为硫酸,由转化关系可知,B为SO2,C为SO2,E为O2,A是一种常见的矿石的主要成分,且A的摩尔质量为120g?mol-1,则A为FeS2;
(2)若A、B、C、D均为含氮元素的化合物,则D为硝酸,且A的一个分子中只含有10个电子,则A为NH3,B为NO,E为O2,C为NO2,以此来解答.
解答:
解:F在常温下是一种无色液体,D为强酸,则F为H2O,则D为硫酸或硝酸.
(1)若A、B、C、D均为含硫元素的化合物,则D为硫酸,由转化关系可知,B为SO2,C为SO2,E为O2,A是一种常见的矿石的主要成分,且A的摩尔质量为120g?mol-1,则A为FeS2,则:
①反应①的化学方程式为:4FeS2+11O2
2Fe2O3+8SO2,故答案为:4FeS2+11O2
2Fe2O3+8SO2;
②甲苯与硝酸发生取代反应生成三硝基甲苯,反应中硫酸起催化剂作用,故答案为:取代反应;催化剂;
(2)若A、B、C、D均为含氮元素的化合物,则D为硝酸,且A的一个分子中只含有10个电子,则A为NH3,B为NO,E为O2,C为NO2,则:
①A为NH3,分子的结构式为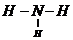 ,故答案为:
,故答案为: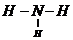 ;
;
②反应④为Cu与硝酸反应生成硝酸铜、NO和水,其离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
③反应生成气体为NO,其物质的量为
=0.1mol,设Cu2O的质量为xg,则Cu的质量为(12-x)g,由电子守恒可知:
×2×(1-0)+
×(2-0)=0.1×(5-2),解得x=4.32,故答案为:4.32.
(1)若A、B、C、D均为含硫元素的化合物,则D为硫酸,由转化关系可知,B为SO2,C为SO2,E为O2,A是一种常见的矿石的主要成分,且A的摩尔质量为120g?mol-1,则A为FeS2,则:
①反应①的化学方程式为:4FeS2+11O2
| ||
| ||
②甲苯与硝酸发生取代反应生成三硝基甲苯,反应中硫酸起催化剂作用,故答案为:取代反应;催化剂;
(2)若A、B、C、D均为含氮元素的化合物,则D为硝酸,且A的一个分子中只含有10个电子,则A为NH3,B为NO,E为O2,C为NO2,则:
①A为NH3,分子的结构式为
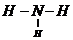 ,故答案为:
,故答案为: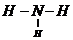 ;
;②反应④为Cu与硝酸反应生成硝酸铜、NO和水,其离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
③反应生成气体为NO,其物质的量为
| 2.24L |
| 22.4L/mol |
| x |
| 144 |
| 12-x |
| 64 |
点评:本题考查无机物推断,涉及N、S元素化合物性质与转化,根据物质含有的元素,结合D为强酸进行推断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
胶体和溶液的根本区别在于( )
| A、外观是否均一 |
| B、分散质粒子是否带电荷 |
| C、分散质粒子的大小 |
| D、分散系是否有颜色 |
将下列各物质分别按等物质的量混合后加水溶解,有沉淀生成的是( )
| A、Na2CO3,NaAlO2,NaOH |
| B、AlCl3,K2SO4,HCl |
| C、CaCl2,Na2CO3,NaOH |
| D、AlCl3,Ba(OH)2,HNO3 |
用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),已知该反应在570K时几乎完全反应,但反应速率极慢.下列说法正确的是( )
| A、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
| D、提高尾气净化效率的最佳途径是使用高效催化剂 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1 mol?L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| B、加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- |
| C、含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- |
| D、0.1mol/LFeCl3溶液中:Na+、NH4+、SCN-、SO42- |
有M、N两种溶液,各含有下列12种离子中的6种,且所含离子各不相同:Al3+、Na+、K+、Cl-、NO3-、OH-、Fe3+、Ba2+、H+、SO32-、MnO4-、AlO2-.已知每组溶液中的阳离子至少有2种,则下列说法正确的是( )
| A、若溶液M呈强酸性,则N中一定含有OH-、NO3- |
| B、若溶液N呈强酸性,则N中一定含有Al3+、可能含有Na+ |
| C、若溶液N无色,则N中一定不含有Fe3+、Cl-,且溶液M有强氧化性 |
| D、常温下,若M、N两溶液混合后pH=7,则至少生成三种沉淀 |
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下: