题目内容
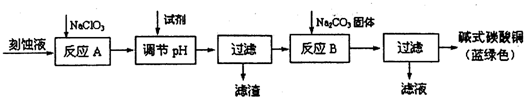
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体.
(2)反应器2中发生反应的离子方程式为 ,SO2的作用是作 剂.
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 .
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 .

(1)冷却过滤的目的是降低NaHSO4的
(2)反应器2中发生反应的离子方程式为
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程为:反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O,NaHSO4的溶解度随着温度的降低而减小,冷却得到NaHSO4晶体,滤液通过蒸馏得到HClO4产品,通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,反应的方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O.
(1)NaHSO4的溶解度随着温度的降低而减小;
(2)二氧化硫具有还原性,二氧化氯具有氧化性;
(3)2NaClO3+Na2SO3+H2SO4═2ClO2+2Na2SO4+H2O中,Cl元素的化合价由+5价降低为+4价产物为还原产物,S元素的化合价由+4价升高为+6价产物为氧化产物;
(4)根据题意高氯酸的沸点:90°C来确定分离方法;根据循环装置中物质的产生和使用知识来回答.
(1)NaHSO4的溶解度随着温度的降低而减小;
(2)二氧化硫具有还原性,二氧化氯具有氧化性;
(3)2NaClO3+Na2SO3+H2SO4═2ClO2+2Na2SO4+H2O中,Cl元素的化合价由+5价降低为+4价产物为还原产物,S元素的化合价由+4价升高为+6价产物为氧化产物;
(4)根据题意高氯酸的沸点:90°C来确定分离方法;根据循环装置中物质的产生和使用知识来回答.
解答:
解:工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程为:反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O,NaHSO4的溶解度随着温度的降低而减小,冷却得到NaHSO4晶体,滤液通过蒸馏得到HClO4产品,通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,反应的方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O.
(1)在反应器1中,硫酸钠和硫酸反应获得的硫酸氢钠的溶解度随着温度的降低而减小,这样冷却过滤,可以降低NaHSO4的溶解度并分离出NaHSO4晶体,
故答案为:溶解度;
(2)在反应器2中,可以实现二氧化氯向NaClO2的转化,二氧化硫可以作为还原剂把ClO2还原为NaClO2,即2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;还原;
(3)2NaClO3+Na2SO3+H2SO4═2ClO2+2Na2SO4+H2O中2molNa2SO4,1mol是Na2SO3氧化得到,为氧化产物,1mol为H2SO4表现酸性的产物,还原产物为ClO2,由反应方程式可得,它们的物质的量之比为1:2,
故答案为:1:2;
(4)根据题意高氯酸的沸点:90C,可以采用蒸馏滤液的方法得到高氯酸,根据循环图可以发现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,可以循环使用,
故答案为:低;H2SO4.
(1)在反应器1中,硫酸钠和硫酸反应获得的硫酸氢钠的溶解度随着温度的降低而减小,这样冷却过滤,可以降低NaHSO4的溶解度并分离出NaHSO4晶体,
故答案为:溶解度;
(2)在反应器2中,可以实现二氧化氯向NaClO2的转化,二氧化硫可以作为还原剂把ClO2还原为NaClO2,即2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;还原;
(3)2NaClO3+Na2SO3+H2SO4═2ClO2+2Na2SO4+H2O中2molNa2SO4,1mol是Na2SO3氧化得到,为氧化产物,1mol为H2SO4表现酸性的产物,还原产物为ClO2,由反应方程式可得,它们的物质的量之比为1:2,
故答案为:1:2;
(4)根据题意高氯酸的沸点:90C,可以采用蒸馏滤液的方法得到高氯酸,根据循环图可以发现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,可以循环使用,
故答案为:低;H2SO4.
点评:本题是一道化工生产过程中的工艺流程,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中,题目难度中等.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1 mol?L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| B、加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- |
| C、含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- |
| D、0.1mol/LFeCl3溶液中:Na+、NH4+、SCN-、SO42- |
下列有关物质的量的说法中,正确的是( )
| A、Mg的摩尔质量为24g |
| B、物质的量的单位是摩尔 |
| C、1 mol O2在任何条件下的体积都为22.4L |
| D、将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1 mol?L-1 |
下列关于杂化轨道的叙述中,不正确的是( )
| A、分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子 |
| C、N2分子中N原子没有杂化,分子中有1个σ键、2个π键 |
| D、H2SO4分子中三种原子均以杂化轨道成键 |
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下: