题目内容
CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应.目前,人们利用光能和催化剂,可将CO2和H2O(g)转化为CH4和O2.请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ?mol-1.将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5min后达到平衡,此时测得CO的物质的量为0.10mol,则5min内CH4的平均反应速率为 .平衡后可以采取下列措施能使n(CO):n(CH4)增大.
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ?mol-1
CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1
①试写出由CO和H2制取甲醇的热化学方程式 .
②该反应的△S 0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行.
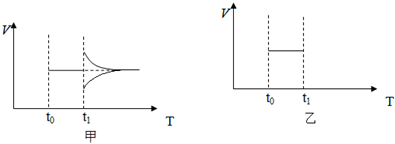
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2):n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1mol),分别在230°C、250°C和270°C进行实验,测得结果如图1,则230℃时的实验结果所对应的曲线是 (填字母);理由是 .列式计算270℃时该反应的平衡常数K: .
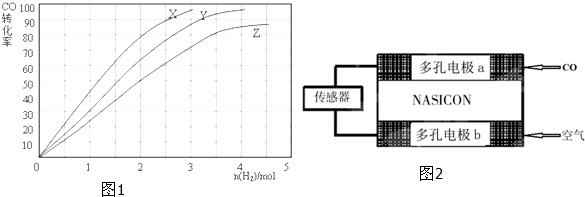
(4)以燃料电池为工作原理测定CO的浓度,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.则负极的反应式 .关于该电池的下列说法,正确的是
A.工作时电极b作正极,O2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中CO的含量越高.
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ?mol-1.将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5min后达到平衡,此时测得CO的物质的量为0.10mol,则5min内CH4的平均反应速率为
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ?mol-1
CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1
①试写出由CO和H2制取甲醇的热化学方程式
②该反应的△S
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2):n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1mol),分别在230°C、250°C和270°C进行实验,测得结果如图1,则230℃时的实验结果所对应的曲线是

(4)以燃料电池为工作原理测定CO的浓度,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.则负极的反应式
A.工作时电极b作正极,O2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中CO的含量越高.
考点:化学平衡的影响因素,原电池和电解池的工作原理,化学平衡的计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)化学反应速率v=
来计算反应速率,根据影响化学平衡移动的因素来回答判断;
(2)根据盖斯定律计算化学反应的焓变;
(3)依据反应是放热反应,温度越高,反应物转化率越小;根据K的表达式代入数据计算;
(4)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大.
| △c |
| △t |
(2)根据盖斯定律计算化学反应的焓变;
(3)依据反应是放热反应,温度越高,反应物转化率越小;根据K的表达式代入数据计算;
(4)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大.
解答:
解:(1)5min内CO的平均化学反应速率v=
=
=0.02mol/(L?min),甲烷表示的平均反应速率和一氧化氮的是相等的,即为0.02mol/(L?min),根据反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ?mol-1,
A.加热升高温度,化学平衡正向移动,所以一氧化碳浓度增加,甲烷浓度减小,所以比值会增大,故A正确;
B.恒温恒容下充入氦气,各组分的浓度不变,所以平衡不移动,比值不变,故B错误;
C.恒温下增大容器体积则压强减小,化学平衡正向移动,所以一氧化碳浓度增加,甲烷浓度减小,所以比值会增大,故C正确;
D.恒温恒容下再充入等物质的量的CH4和H2O,相当于增大压强,化学平衡逆向动,所以一氧化碳浓度减小,甲烷浓度增加,所以比值会减小,故D错误;故选AC,
故答案为:0.02mol/(L?min);AC;
(2)①已知①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1
则①-②得CO(g)+2H2(g)?CH3OH(l)△H=(-49.5kJ?mol-1 )-41.3kJ/mol)=-90.8kJ?mol-1,
故答案为:CO(g)+2H2(g)?CH3OH(l)△H=-90.8 kJ?mol-1;
②该反应是气体减少的反应,所以△S<0,根据△G=△H-T△S<0自发,△H<0,△S<0,所以在低温下有利于该反应自发进行;故答案为;<;在低温下;
(3)工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图.合成甲醇是放热反应,温度越低转化率越大,结合图象可知,230℃的实验结果所对应的曲线是X;270℃时该反应的平衡常数K=
=
=1,
故答案为:X,该反应是放热反应,温度越低转化率越高;K=
=
=1;
(4)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,
A.工作时电极b通入空气,b作正极,阴离子向负极移动,O2-由电极b流向电极a,故A正确;
B.原电池放电时电子从负极流向正极,故电流由电极b通过传感器流向电极a,故B错误;
C.一氧化碳的含量越大,原电池放电时产生的电流越大,故C正确,
故答案为:CO-2e-+O2-═CO2;AC.
| △c |
| △t |
| ||
| 5min |
A.加热升高温度,化学平衡正向移动,所以一氧化碳浓度增加,甲烷浓度减小,所以比值会增大,故A正确;
B.恒温恒容下充入氦气,各组分的浓度不变,所以平衡不移动,比值不变,故B错误;
C.恒温下增大容器体积则压强减小,化学平衡正向移动,所以一氧化碳浓度增加,甲烷浓度减小,所以比值会增大,故C正确;
D.恒温恒容下再充入等物质的量的CH4和H2O,相当于增大压强,化学平衡逆向动,所以一氧化碳浓度减小,甲烷浓度增加,所以比值会减小,故D错误;故选AC,
故答案为:0.02mol/(L?min);AC;
(2)①已知①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1
则①-②得CO(g)+2H2(g)?CH3OH(l)△H=(-49.5kJ?mol-1 )-41.3kJ/mol)=-90.8kJ?mol-1,
故答案为:CO(g)+2H2(g)?CH3OH(l)△H=-90.8 kJ?mol-1;
②该反应是气体减少的反应,所以△S<0,根据△G=△H-T△S<0自发,△H<0,△S<0,所以在低温下有利于该反应自发进行;故答案为;<;在低温下;
(3)工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图.合成甲醇是放热反应,温度越低转化率越大,结合图象可知,230℃的实验结果所对应的曲线是X;270℃时该反应的平衡常数K=
| c(CH 3OH) |
| c(CO)?c 2(H 2) |
| 0.5 |
| 0.5×1 2 |
故答案为:X,该反应是放热反应,温度越低转化率越高;K=
| c(CH 3OH) |
| c(CO)?c 2(H 2) |
| 0.5 |
| 0.5×1 2 |
(4)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,
A.工作时电极b通入空气,b作正极,阴离子向负极移动,O2-由电极b流向电极a,故A正确;
B.原电池放电时电子从负极流向正极,故电流由电极b通过传感器流向电极a,故B错误;
C.一氧化碳的含量越大,原电池放电时产生的电流越大,故C正确,
故答案为:CO-2e-+O2-═CO2;AC.
点评:本题涉及化学平衡的影响因素以及热化学方程式的书写和焓变的计算知识,属于综合知识的考查,难度大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列有关叙述正确的是( )
| A、配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水 |
| B、将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液 |
| C、如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗 |
| D、最好用蒸馏的方法分离出CCl4和水的混合物 |
25℃时,下列关于电解质及其溶液的说法,正确的是( )
| A、BaSO4在饱和Na2SO4溶液中的溶解度与Ksp均比在纯水中的小 |
| B、若将0.01molNaOH溶于1L水,则溶液中由水电离产生的c(H+)=1×10-12mol?L-1 |
| C、10ml0.5mol?L-1CH3COONa溶液与6ml1mol?L-1盐酸混合:c(Cl-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| D、pH=4的HA与pH=10的BOH溶液等体积混合,所得溶液pH=7,则HA、BOH一定为强酸和强碱 |
下列关于杂化轨道的叙述中,不正确的是( )
| A、分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子 |
| C、N2分子中N原子没有杂化,分子中有1个σ键、2个π键 |
| D、H2SO4分子中三种原子均以杂化轨道成键 |
危险化学药品的包装标签上要印有警示性标志,下列物质选用“易燃品”标志的是( )
| A、酒精 | B、烧碱 |
| C、浓硫酸 | D、氯酸钾 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①太阳能 ②生物质能 ③风能 ④氢能 ⑤煤 ⑥石油 ⑦天然气 ⑧核能.
①太阳能 ②生物质能 ③风能 ④氢能 ⑤煤 ⑥石油 ⑦天然气 ⑧核能.
| A、①②③④ | B、⑤⑥⑦⑧ |
| C、①②③④⑧ | D、①③④⑦⑧ |
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下: