题目内容
10.铁和铝均可在冷的浓硫酸或浓硝酸中发生钝化,即在表面生成一层致密的氧化膜;“铁红”的主要化学成分是Fe2O3;Fe2(SO4)3溶液呈棕黄色;生铁主要是铁和碳的合金.分析 铁和铝均可在冷的浓硫酸或浓硝酸中表面形成致密的氧化膜,而发生钝现象,氧化铁叫铁红,铁离子呈黄,铁和碳形成的合金叫钢和生铁,由此分析解答.
解答 解:铁和铝均可在冷的浓硫酸或浓硝酸中表面形成致密的氧化膜,而发生钝现象,氧化铁叫铁红,铁离子呈黄,铁和碳形成的合金叫钢和生铁,
故答案为:硝;氧化膜;Fe2O3;棕黄;碳.
点评 本题考查元素化合物知识,学生要熟记相关物质的俗名和成份,比较容易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.“瘦肉精”对人体健康会产生危害,已知某种“瘦肉精”含有克伦特罗,其结构如下图所示.下列有关克伦特罗的叙述不正确的是( )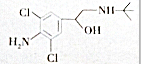

| A. | 该物质含有苯环,属于芳香族化合团 | |
| B. | 该物质只含有-OH,-NH2两种官能团 | |
| C. | 该物质含有-OH,就具有-OH的性质 | |
| D. | 该物质能发生氧化反应 |
1.辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下: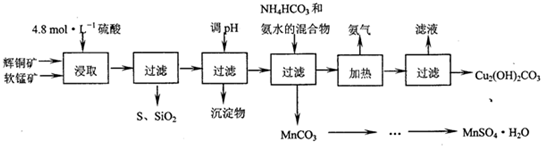
已知:①MnO2能将金属化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的PH范围如下表示(开始沉淀的PH按金属离子浓度为1.0mol•L-1计算)
:
(1)酸浸时,为了提高浸取率可采取的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌)(任写一点).
(2)调节浸出液pH的范围为3.2≤PH<4.4,其目的是使Fe3+转化为氢氧化铁沉淀而除去.
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成碱式碳酸铜产量减少的结果.
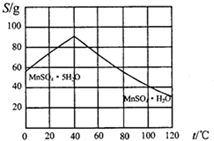
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4•H2O的实验方案为蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥.
(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有混有硫酸盐杂质或者部分晶体失去结晶水(写一种)

已知:①MnO2能将金属化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的PH范围如下表示(开始沉淀的PH按金属离子浓度为1.0mol•L-1计算)
:
| 开始沉淀的PH | 沉淀完全的PH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(2)调节浸出液pH的范围为3.2≤PH<4.4,其目的是使Fe3+转化为氢氧化铁沉淀而除去.
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成碱式碳酸铜产量减少的结果.
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4•H2O的实验方案为蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥.

(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有混有硫酸盐杂质或者部分晶体失去结晶水(写一种)
18.下列指定反应的离子方程式正确的是( )
| A. | NaHS03溶液显酸性:HS03-═H++S032- | |
| B. | 苯酚钠溶液中通入少量C02: C6H50+CO2+H20→C6H50H+HCO3- | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2Fe042-+3Cl-+H20+4H+ | |
| D. | 向 Ca(Cl0)2 溶液中通入过量 S02:Ca2++2C10-+SO2═CaSO4↓+2Cl- |
5.用如图所示实验装置(夹持仪器已略去)探究铜丝与足量浓硫酸的反应.下列有关说法不正确的是( )


| A. | 浓硫酸的还原产物是SO2 | |
| B. | 该装置可随时控制反应的发生或停止 | |
| C. | ①中有白色固体生成,加水后溶液呈蓝色 | |
| D. | ②中盛放Ba(NO3)2溶液可吸收SO2,防止空气污染 |
15.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一.回答下列问题:
(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母代号).

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如下表所示
(前6min没有改变条件):
①X=0.14,250℃时该反应的平衡常数K=46.3.
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸.在常温下,甲酸的K=1×10-4,20.00mL 0.1000mol/L NaOH溶液与一定量等浓度甲酸溶液混合后所得溶液的c(HCOOH)=c(HCOO-),该溶液pH=4,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母代号).

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如下表所示
(前6min没有改变条件):
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸.在常温下,甲酸的K=1×10-4,20.00mL 0.1000mol/L NaOH溶液与一定量等浓度甲酸溶液混合后所得溶液的c(HCOOH)=c(HCOO-),该溶液pH=4,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
19.NA表示阿伏伽德罗常数,1molNaOH固体含有( )
| A. | NA个OH- | B. | 3NA个离子 | C. | 2NA原子 | D. | 10NA个电子 |
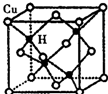 铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).
铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).