题目内容
1.辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下: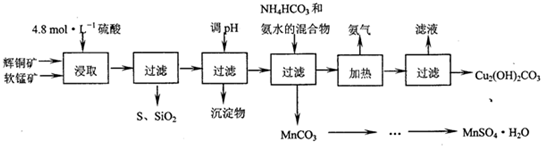
已知:①MnO2能将金属化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的PH范围如下表示(开始沉淀的PH按金属离子浓度为1.0mol•L-1计算)
:
| 开始沉淀的PH | 沉淀完全的PH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(2)调节浸出液pH的范围为3.2≤PH<4.4,其目的是使Fe3+转化为氢氧化铁沉淀而除去.
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成碱式碳酸铜产量减少的结果.
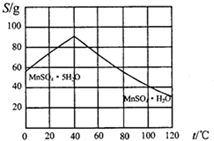
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4•H2O的实验方案为蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥.
(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有混有硫酸盐杂质或者部分晶体失去结晶水(写一种)
分析 辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,都含少量Fe2O3、SiO2等杂质,加入稀硫酸浸取,过滤得到SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,用氨水调节溶液pH使铁离子转化为氢氧化铁过滤除去,不会引入新杂质,滤液中加入碳酸氢铵和氨水,使锰离子转化为碳酸锰,碳酸锰再与硫酸反应,经过蒸发结晶得到硫酸锰晶体.过滤得到滤液赶出的氨气可以循环使用,同时得到碱式碳酸铜.
(1)矿石颗粒大小影响反应速率,温度升高反应加快,搅拌也可以提高浸取率;
(2)调节溶液pH目的是除去Fe3+离子,Cu2+、Mn2+不能沉淀;
(3)氨气可以循环利用;
(4)温度过高,碱式碳酸铜为分解,温度过低,会有较多的[Cu(NH3)4]SO4存在;
(5)低于40℃结晶析出MnSO4.5H2O,高于40℃结晶析出MnSO4.H2O,趁热过滤,用酒精洗涤,减少溶解损失,在低温下干燥,防止失去结晶水;
(6)可能洗涤不干净,混有硫酸盐,或者部分晶体失去结晶水等.
解答 解:辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,都含少量Fe2O3、SiO2等杂质,加入稀硫酸浸取,过滤得到SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,用氨水调节溶液pH使铁离子转化为氢氧化铁过滤除去,不会引入新杂质,滤液中加入碳酸氢铵和氨水,使锰离子转化为碳酸锰,碳酸锰再与硫酸反应,经过蒸发结晶得到硫酸锰晶体.过滤得到滤液赶出的氨气可以循环使用,同时得到碱式碳酸铜.
(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率,
故答案为:粉碎矿石、升高温度(或适当增加酸的浓度或搅拌);
(2)调节溶液pH目的是使Fe3+转化为氢氧化铁沉淀而除去,Cu2+、Mn2+不能沉淀,可以用氨水,不会引入新杂质,要除去滤液中的Fe3+离子,溶液pH=3.2使Fe3+离子完全沉淀,溶液pH=4.4时铜离子开始沉淀,故pH范围是3.2≤pH<4.4,
故答案为:3.2≤PH<4.4;使Fe3+转化为氢氧化铁沉淀而除去;
(3)由上述分析可知,NH3可以循环利用,
故答案为:NH3;
(4)温度过高,碱式碳酸铜为分解,温度过低,会有较多的[Cu(NH3)4]SO4存在,都将造成碱式碳酸铜产量减少,
故答案为:碱式碳酸铜产量减少;
(5)低于40℃结晶析出MnSO4.5H2O,高于40℃结晶析出MnSO4.H2O,由硫酸锰溶液制备MnSO4•H2O的实验方案为:蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥,
故答案为:蒸发、结晶温度高于40℃,趁热过滤,用酒精洗涤,低温干燥;
(6)可能洗涤不干净,混有硫酸盐杂质,或者部分晶体失去结晶水等,导致样品纯度大于100%,
故答案为:混有硫酸盐杂质或者部分晶体失去结晶水.
点评 本题属于化学工艺流程题目,以物质制备为载体,考查物质分离提纯、实验条件控制、信息提取与迁移运用,关键是理解工艺流程,较好的考查学生分析能力、化学实验能力,难度中等.

| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒感染,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响,PM2.5引起的雾霾一定属于气溶胶. | |
| C. | 陶瓷、玻璃和光导纤维都是硅酸盐材料 | |
| D. | 原子结构模型的演变经历了: |
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到表1的数据:
温度试剂
表1
| 试剂 温度 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热
(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中
加入10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84(m_{1}-m_{2})}{31m_{1}}$×100%(用代数式表示).
附表:溶解度表
温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
| A. | 新制氯水 | B. | 久置氯水 | C. | 氯化钠 | D. | 氯化氢 |
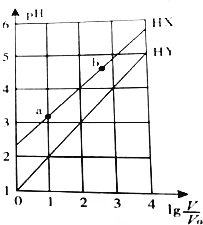
| A. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | 常温下,由水电离出的c(H+)•c(OH-):a<b | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
| A. | 在加热条件下能使不活泼金属铜溶解,表现出浓硫酸的强氧化性和酸性 | |
| B. | 可以用铁制或铝制容器贮运,表现出浓硫酸有稳定的化学性质 | |
| C. | 能使胆矾晶体由蓝色变为白色,表现出浓硫酸的脱水性 | |
| D. | 能使蔗糖炭化,表现出浓硫酸的吸水性 |
| A. | NaOH+HCl═NaCl+H2O | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | ||
| C. | SO3+H2O═H2SO4 | D. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |