题目内容
19.回答下列问题(1)二氧化碳的摩尔质量是44g/mol,1mol二氧化碳的质量是44g,它含有6.02×1023 个二氧化碳分子;4.4g二氧化碳中所含的氧原子数与49g H2S04中所含的氧原子数相等.
(2)与16g氧气所含有分子数相同的氨气是8.5,与16g氧气所含原子总数相同的氨气是4.25g;在相同条件下,在5.6g氮气中应添加5.1g氨气所组成的混合气体与16g氧气所占的体积相等.
(3)将质量比为7:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为1:2;氮原子和氧原子的个数之比为2:1;1mol该混合气体的质量为29.3g;22克该混合气体在标准状况下的体积为16.8L.
分析 (1)摩尔质量以g/mol为单位,数值上等于其相对分子质量;根据m=nM计算二氧化碳的质量,根据N=nNA计算二氧化碳分子数目;根据根据n=$\frac{m}{M}$计算硫酸物质的量,根据氧原子数目相等计算二氧化碳的物质的量,根据m=nM计算二氧化碳的质量;
(2)根据n=$\frac{m}{M}$计算氧气物质的量,分子数目相等则气体物质的量相等,根据m=nM计算氨气质量;根据原子数目相等计算氨气物质的量,根据m=nM计算氨气质量;相同条件下气体的条件相等,则物质的量相等;
(3)根据n=$\frac{m}{M}$计算N2和NO的物质的量之比;结合分子式计算含有N、O原子数目之比;计算平均摩尔质量,可得1mol该混合气体的质量;根据n=$\frac{m}{M}$计算混合气体物质的量,再根据V=nVm计算体积.
解答 解:(1)摩尔质量以g/mol为单位,数值上等于其相对分子质量,二氧化碳的摩尔质量为44g/mol;
1mol二氧化碳的质量为44g,二氧化碳分子数目为1mol×6.02×1023 mol-1=6.02×1023 ;
4.9g硫酸的物质的量为$\frac{4.9g}{98g/mol}$=0.05mol,与之含有相等氧原子数目的二氧化碳为$\frac{0.05mol×4}{2}$=0.1mol,二氧化碳的质量为0.1mol×44g/mol=4.4g,
故答案为:44g/mol;44g;6.02×1023 ;4.4;
(2)16g 氧气物质的量为$\frac{16g}{32g/mol}$=0.5mol,分子数目相等则气体物质的量相等,故氨气质量为0.5mol×17g/mol=8.5g;
原子数目相等,则氨气物质的量为$\frac{0.5mol×2}{4}$=0.25mol,氨气质量为0.25mol×17g/mol=4.25g;
相同条件下气体的条件相等,则物质的量相等,故氨气的物质的量为0.5mol-$\frac{5.6g}{28g/mol}$=0.3mol,则氨气质量为0.3mol×17g/mol=5.1g,
故答案为:8.5;4.25;5.1;
(3)质量比为7:15的N2和NO混合,根据n=$\frac{m}{M}$可知混合气体中N2和NO的物质的量之比为$\frac{7}{28}$:$\frac{15}{30}$=1:2;结合分子式,可知含有N、O原子数目之比为(2+1×2):2=2:1,平均摩尔质量为$\frac{28g/mol×1mol+30g/mol×2}{1mol+2mol}$=$\frac{88}{3}$g/mol=29.3g/mol,可得1mol该混合气体的质量为29.3g;22克该混合气体在标准状况下的体积为$\frac{22g}{\frac{88}{3}g/mol}$×22.4L/mol=16.8L,
故答案为:1:2;2:1;29.3g;16.8L.
点评 本题考查物质的量有关计算,注意掌握以物质的量为中心的有关计算,有利于基础知识的巩固.

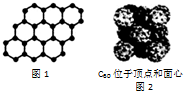
| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
| A. | 海水资源的利用包括海水水资源利用和化学资源利用 | |
| B. | 海水晒盐的过程中只发生了物理变化 | |
| C. | 从海水中可以得到NaCl,电解熔融NaCl可制备Cl2 | |
| D. | 海水中金元素总储量很大,适合于大规模工业开采 |
①异丁烷和新戊烷 ②NH4CNO和CO(NH2)2
③C2H5NO2和NH2CH2COOH ④2,3-二甲基戊烷和2,2,3-三甲基丁烷.
| A. | ①②③ | B. | ②③④ | C. | ②③ | D. | ③④ |
| A. | 18gD2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L硫酸溶液中含有氢离子数目为NA | |
| C. | 标准状况下,22.4LSO3所含有的分子数目为NA | |
| D. | 过氧化钠与水反应时生成0.1mol氧气转移的电子数为0.2NA |
| A. | 质量相等密度不等的N2和C2H4 | B. | 等体积等密度的CO和C2H4 | ||
| C. | 等温、等压,等体积的O2和N2 | D. | 常温常压下,等质量的NO和CO |
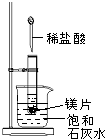 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题: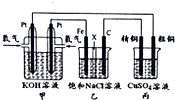 某同学设计了一个氢氧燃料电池(如图所示),目的是探究氯碱工业(人们习惯上把电解饱和食盐水的工业叫做氯碱工业)原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
某同学设计了一个氢氧燃料电池(如图所示),目的是探究氯碱工业(人们习惯上把电解饱和食盐水的工业叫做氯碱工业)原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.