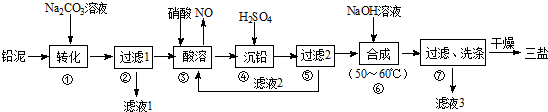
题目内容
6.通过资源化利用的方式将CO2转化为具有工业应用价值的产品,是一种较为理想的减排方式.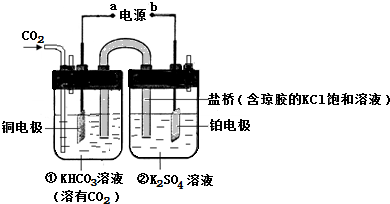
(1)图是CO2电催化还原为CH4的工作原理示意图.回答下列问题:
①一段时间后,②池中溶液的pH降低. (填“升高”、“降低”或“不变”)②一段时间后,①池中n(KHCO3)减少的原因是电解池的阴极上发生二氧化碳得电子的还原反应,即CO2+8H++8e-═CH4+2H2O,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小(用有关的方程式和简要的文字说明).
③铜电极的电极反应式为CO2+8H++8e-═CH4+2H2O.
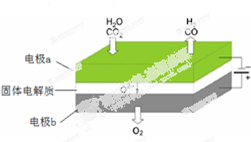
(2)高温电解技术能高效实现下面反应:+HO$\frac{\underline{\;电解\;}}{高温}$+H+O
该反应的工作原理示意如图:写出CO2在电极a放电的反应式CO2+2e-═CO+O2-.
分析 (1)在电解池的阳极上,是阴离子发生失电子的氧化反应,在电解池的阴极上发生二氧化碳得电子的还原反应,CO2电催化还原为CH4的过程CO2+8H++8e-═CH4+2H2O是一个还原反应过程,据此回答;
(2)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;电极b氧离子失去电子发生氧化反应生成氧气.
解答 解:(1)在电解池的阳极上,是阴离子氢氧根离子发生失电子的氧化反应,所以酸性增强,pH一定下降,即②池中溶液的pH降低;在电解池的阴极上发生二氧化碳得电子的还原反应,即CO2+8H++8e-═CH4+2H2O,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小,CO2电催化还原为CH4的过程是一个还原反应过程,所以铜电解是电解池的阴极,铜电极的电极反应式为CO2+8H++8e-═CH4+2H2O,
故答案为:降低;电解池的阴极上发生二氧化碳得电子的还原反应,即CO2+8H++8e-═CH4+2H2O,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小;CO2+8H++8e-═CH4+2H2O;
(2)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,
故答案为:CO2+2e-═CO+O2-.
点评 本题考查学生电解池的工作原理知识,注意两极反应式的书写以及氧化还原反应之间的关系,注意规律的总结是关键,难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
10.下列有关元素性质比较正确的是( )
| A. | 氢化物稳定性:PH3>H2S>HCl | B. | 沸点:H2O>HF>HCl | ||
| C. | 原子半径:S>F>O | D. | 酸性:HClO>HNO3>H2CO3 |
14.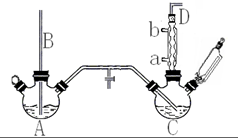 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
则lt苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$tt(只要求列式)
 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
1.流行性感冒期间,某同学将食盐溶解于水,通直流电电解(2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑),并将生成的Cl2与NaOH溶液反应得消毒液.该消毒液的有效成分是( )
| A. | NaOH | B. | NaClO | C. | NaCl | D. | Cl2 |
18.把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为( )
| A. | 1.0 mol/L | B. | 2.0 mol/L | C. | 3.0 mol/L | D. | 4.0 mol/L |
15.以下四种共价键分子的球棍模型中,可表示N2分子的是( )
| A. |  | B. |  | C. |  | D. |  |
16.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Na被完全氧化生成Na2O2,失去2NA个电子 | |
| B. | 常温常压下,18 g H2O 中含有的原子总数为3NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| D. | 1 mol Cl2与1 mol Fe反应,转移的电子数为3NA |