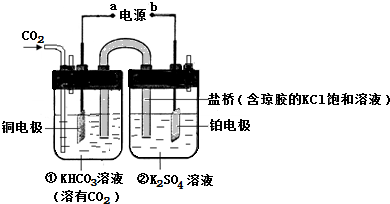
题目内容
10.下列有关元素性质比较正确的是( )| A. | 氢化物稳定性:PH3>H2S>HCl | B. | 沸点:H2O>HF>HCl | ||
| C. | 原子半径:S>F>O | D. | 酸性:HClO>HNO3>H2CO3 |
分析 A、元素的非金属性越强,对应的氢化物越稳定;
B、含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高;
C、同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A、非金属性:Cl>S>P,元素的非金属性越强,对应的氢化物越稳定是HCl>H2S>PH3,故A错误;
B、有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:H2O>HF>HCl,故B正确;
C、同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径S>O>F,故C错误;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>C,虽然Cl的非金属性较强,但HClO属于弱酸,所以酸性强弱HNO3>H2CO3>HClO,故D错误;
故选B.
点评 本题考查了元素性质的递变规律,题目难度不大,注意把握非金属元素的性质的变化规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列叙述不正确的是( )
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液的pH不变 | |
| B. | 原电池的正极和电解池的阴极所发生的反应都是还原反应 | |
| C. | 电解精炼铜时粗钢作阳极、精铜作阴极、溶液中含有铜离子 | |
| D. | 在铁制品上镀锌的方案设计是锌作阳极、镀件作阴极、溶液中含有锌离子 |
18.下列离子方程式书写正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 盐酸滴入氢氧化钡溶液中:H++OH-=H2O | |
| D. | 氯气通入NaOH溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
5.下列有关药品的保存说法错误的是( )
| A. | 水玻璃可保存在带玻璃塞的玻璃瓶中 | |
| B. | 钠保存在煤油中 | |
| C. | 液氯可以保存钢瓶中 | |
| D. | 过氧化钠、漂白粉要密封保存 |
15.下列氧化还原反应中,水作为还原剂的是( )
| A. | 3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
2. 某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
 某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )| A. | 该有机物遇氯化铁溶液不呈紫色 | |
| B. | 1mol该有机物能与6mol氢氧化钠反应 | |
| C. | 该有机物能与6mol金属钠反应生成6molH2 | |
| D. | 在稀硫酸存在下可以发生水解反应,但水解的产物只有一种有机物 |
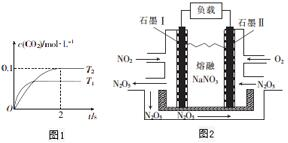 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.