题目内容
13.PMAA是一种“智能型”高分子化合物,可用于生物制药中大分子与小分子的分离.下列是以有机物A为起始反应物合成PMAA的路线.
根据上述过程回答下列可题:
(1)写出下列物质的结构简式:ACH2=C(CH3)-CH3,PMAA
 .
.(2)写出反应类型:①加成反应,②取代反应,③消去反应.
(3)写出反应③的化学方程式:
 $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.(4)E在有浓硫酸和加热条件下,还可能生成一种六元环状化合物,其结构简式为
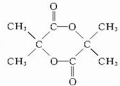 .
.
分析 F含有碳碳双键,发生加聚反应生成高分子化合物PMAA,故PMAA为 ,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为
,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为 ,逆推可知D为
,逆推可知D为 ,C为
,C为 ,B为
,B为 ,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3,据此解答.
,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3,据此解答.
解答 解:F含有碳碳双键,发生加聚反应生成高分子化合物PMAA,故PMAA为 ,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为
,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为 ,逆推可知D为
,逆推可知D为 ,C为
,C为 ,B为
,B为 ,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
(1)由上述分析可知,A的结构简式为:CH2=C(CH3)-CH3,PMAA的结构简式为 ,
,
故答案为:CH2=C(CH3)-CH3; ;
;
(2)反应①是烯烃发生加成反应,反应②是卤代烃的水解反应,属于取代反应,反应③是醇发生消去反应生成碳碳双键,
故答案为:加成反应;取代反应;消去反应;
(3)反应③的化学方程式: $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O,
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O,
故答案为: $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O;
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O;
(4)E( )在浓硫酸存在并加热的条件下,还能生成一种环状产物,应发生酯化反应生成环酯,该环状化合物的结构简式是
)在浓硫酸存在并加热的条件下,还能生成一种环状产物,应发生酯化反应生成环酯,该环状化合物的结构简式是 ,
,
故答案为: .
.
点评 本题考查有机物的推断,注意根据F的结构与反应条件抓住碳链骨架进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
相关题目
1.甲乙两同学对保存已久的Na2SO3试剂进行试验探究.
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O HSO3-+OH-
HSO3-+OH-
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量.实验如下:
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O
 HSO3-+OH-
HSO3-+OH-(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
8.下列叙述正确的是( )
| A. | 1mol H2O的质量为18g/mol | |
| B. | 2g H2含有的氢原子数为6.02×1023 | |
| C. | 标准状况下,1mol SO3的体积为22.4L | |
| D. | 1L 1mol•L-1 NaOH溶液中含1mol Na+ |
18.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 25℃时,向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1的CH3COONa溶液与0.1mol•L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 浓度均为0.1mol•L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>① |
3.有关下列微粒的化学用语正确的是( )
| A. | CS2的电子式为: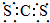 | |
| B. | Ca2+的离子结构示意图为: | |
| C. | HClO的结构式为:H-Cl-O | |
| D. | 质子数为35,中子数为46的核素的核素符号为:${\;}_{35}^{81}$Br |
20.有机化合物 的官能团是( )
的官能团是( )
 的官能团是( )
的官能团是( )| A. | 醛基 | B. | 羧基 | C. | 羟基 | D. | 醚键 |
1.在铜与稀硝酸的反应中,如果有1mol的硝酸被还原,则被氧化的铜的物质的量为( )
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |