题目内容
9.下列说法错误的是( )| A. | 原子半径:F<Mg<K | B. | 碱性:Al(OH)3<Mg(OH)2<KOH | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 稳定性:PH3>H2S>NH3 |
分析 A.电子层越多,原子半径越大;
B.金属性越强,对应最高价氧化物的水化物碱性越强;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.电子层越多,原子半径越大,则原子半径:F<Mg<K,故A正确;
B.金属性K>Mg>Al,对应最高价氧化物的水化物碱性为Al(OH)3<Mg(OH)2<KOH,故B正确;
C.非金属性Cl>S>P,对应最高价氧化物的水化物酸性为H3PO4<H2SO4<HClO4,故C正确;
D.非金属性N>P、S>P,对应氢化物稳定性为NH3>PH3,H2S>PH3,故D错误;
故选D.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质和元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
1.甲乙两同学对保存已久的Na2SO3试剂进行试验探究.
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O HSO3-+OH-
HSO3-+OH-
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量.实验如下:
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O
 HSO3-+OH-
HSO3-+OH-(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
20.有机化合物 的官能团是( )
的官能团是( )
 的官能团是( )
的官能团是( )| A. | 醛基 | B. | 羧基 | C. | 羟基 | D. | 醚键 |
17.某研究性学习小组在实验室中配制1mol•L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液,下列有关说法错误的是:( )
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60 mL的稀硫酸标准溶液,配制时应选用100 mL容量瓶 | |
| C. | 酸式滴定管用蒸馏水洗涤后,即装入稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| D. | 滴定终点时,仰视滴定管的刻度,其他操作正确,测得的NaOH溶液的浓度将偏小 |
4.塑料抗氧化剂C可通过下列反应合成:
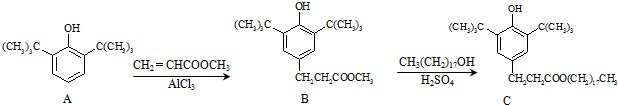
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所含碳原子可能在同一个平面内 | |
| B. | 物质A生成物质B是加成反应,物质B生成物质C是酯化反应 | |
| C. | 物质B具有酚羟基,但不能与浓溴水产生白色沉淀 | |
| D. | 1mol抗氧化剂C能与NaOH溶液反应,最多消耗3 molNaOH |
1.在铜与稀硝酸的反应中,如果有1mol的硝酸被还原,则被氧化的铜的物质的量为( )
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
18.H-H键的键能是436kJ•mol-1,I-I键的键能是151kJ•mol-1,H-I键的键能是299kJ•mol-1.则对反应H2(g)+I2(g)?2HI(g)的说法,不正确的是( )
| A. | 氧化还原反应 | B. | 放热反应 | C. | 化合反应 | D. | 吸热反应 |
19.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以判断汽车司机是否酒后驾车.反应的化学方程式如下:2CrO3+3C2H5OH+3H2SO4═Cr2(SO4)3+3CH3CHO+6H2O
下列有关说法正确的是( )
下列有关说法正确的是( )
| A. | C2H5OH是氧化剂 | B. | C2H5OH发生氧化反应 | ||
| C. | CrO3是还原剂 | D. | H2SO4是氧化剂 |