题目内容
(1)某同学欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:

①B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;C中反应的离子方程式为 .
②为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是(写2点) 、 .
(2)工业上,在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,从而制得过氧化氢.将过氧化氢溶液与消石灰反应,经过滤、洗涤、干燥,可得过氧化钙晶体.
①写出电解过程中氧气参与的阴极反应方程式 .
②H2O2与Ca(OH)2反应时,若不加稳定剂,需控制温度0~5℃,原因是: .
③常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法正确的是 .
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+.

①B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为
②为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是(写2点)
(2)工业上,在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,从而制得过氧化氢.将过氧化氢溶液与消石灰反应,经过滤、洗涤、干燥,可得过氧化钙晶体.
①写出电解过程中氧气参与的阴极反应方程式
②H2O2与Ca(OH)2反应时,若不加稳定剂,需控制温度0~5℃,原因是:
③常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+.
考点:性质实验方案的设计,二氧化硫的化学性质
专题:实验设计题
分析:(1)①铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,检验二氧化硫漂白性可以通过品红试液;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;
②依据装置图对比分析不同,总结优点;
(2)①在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,依据电荷守恒书写电极反应;
②依据过氧化氢不稳定分解生成水和氧气;
③根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,结合具体的化学反应来解答.
②依据装置图对比分析不同,总结优点;
(2)①在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,依据电荷守恒书写电极反应;
②依据过氧化氢不稳定分解生成水和氧气;
③根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,结合具体的化学反应来解答.
解答:
解:(1)①由装置图可知,铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,C检验二氧化硫的还原性,D检验二氧化硫的氧化性,检验二氧化硫漂白性可以通过品红试液,品红褪色是二氧化硫气体的特性;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;反应的两种方程式为:SO2+I2+2H2O═SO42-+2I-+4H+,
故答案为:品红溶液;SO2+I2+2H2O═SO42-+2I-+4H+;
②由装置图可知,A2的制取装置来代替A1装置,可以不需要加热或节约能源或药品,用分液漏斗加入硫酸可以控制反应速率,易于控制反应进行;或反应更充分,
故答案为:不用加热或节约能源或药品;或易于控制反应进行;
(2)①在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,电解过程中氧气参与的阴极反应方程式为:O2+H2O+2e-=HO2-+OH-,
故答案为:O2+H2O+2e-=HO2-+OH-;
②H2O2与Ca(OH)2反应时,若不加稳定剂,需控制温度0~5℃,是因为过氧化氢受热易分解,故答案为:过氧化氢受热易分解;
③A.由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,故A错误;
B.将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,双氧水溶液本身是弱酸性,而分解生成的水是中性,溶液pH值升高,故B错误;
C.H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,故C正确;
D.因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故D正确.
故选:CD.
故答案为:品红溶液;SO2+I2+2H2O═SO42-+2I-+4H+;
②由装置图可知,A2的制取装置来代替A1装置,可以不需要加热或节约能源或药品,用分液漏斗加入硫酸可以控制反应速率,易于控制反应进行;或反应更充分,
故答案为:不用加热或节约能源或药品;或易于控制反应进行;
(2)①在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,电解过程中氧气参与的阴极反应方程式为:O2+H2O+2e-=HO2-+OH-,
故答案为:O2+H2O+2e-=HO2-+OH-;
②H2O2与Ca(OH)2反应时,若不加稳定剂,需控制温度0~5℃,是因为过氧化氢受热易分解,故答案为:过氧化氢受热易分解;
③A.由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,故A错误;
B.将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,双氧水溶液本身是弱酸性,而分解生成的水是中性,溶液pH值升高,故B错误;
C.H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,故C正确;
D.因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故D正确.
故选:CD.
点评:本题考查了二氧化硫性质的实验验证方法和实验设计分析步骤、电解原理的分析判断、氧化还原反应,明确反应中氧化性的比较规律及两个化学反应的关系及催化剂在反应在的作用即可解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容. 你认为该同学的错误步骤有
你认为该同学的错误步骤有 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.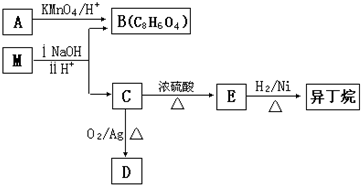 苯的同系物是人类最早认识的芳香族化合物,其中对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料.
苯的同系物是人类最早认识的芳香族化合物,其中对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料.