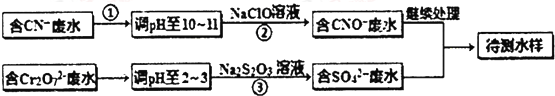
题目内容
5.中科院大连化学物理研究所的“煤基甲醇制取低碳烯烃技术(简称DMTO)”荣获国家技术发明一等奖.DMTO技术主要包括煤的气化.液化.烯烃化三个阶段,相关反应的热化学方程式如下:(i) 煤气化制合成气:C(s)+H2O(g)?CO(g)+H2(g)
(ii) 煤液化制甲醇:CO(g)+2H2(g)?CH3OH(g)
回答下列问题:
(1)已知:C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
①反应( i)能自发进行的条件是高温(填“高温”.“低温”或“任何温度”).
②等温等容时,密闭容器中进行的该反应,下列各项能说明该反应已经达到平衡状态的是:ABD
A.混合气体的密度不变 B.该容器内气体的总压强不变
C.相同时间内生成H2的量与消耗了的 H2O 的量相等 D.CO的体积分数不变
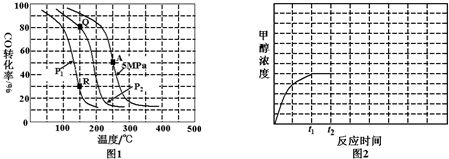
(2)反应(ii)中以氢碳[n(H2):n(CO)]投料比为2制取甲醇,温度、压强与CO的平衡转化率关系如图1.
①反应(ii)平衡常数表达式:Kc=$\frac{[C{H}_{3}OH]}{[CO]•[{H}_{2}]^{2}}$,
②对于反应(ii)比较P1小于P2,Kc(Q)等于Kc(R)(填“大于”.“小于”或“等于”).
③若反应(ii)在恒容密闭容器内进行,T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t2时刻迅速降温到T2,t3时刻体系重新达到平衡.试在图中画出t2时刻后甲醇浓度随时间变化趋势图(在图中标出t3).
分析 (1)①通过已知:(i)C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
(ii)CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
计算反应C(s)+H2O(g)?CO(g)+H2(g)的△H,反应△S>0,根据△G=△H-T•△S<0反应自发进行分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①平衡常数等于生成物平衡浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值;
②150℃时,比较Q和R两点对应的CO的转化率的大小,得出平衡移动的方向,从而判断压强的改变;Kp只受温度的影响;
③反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变.
解答 解:(1)①已知:(i)C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
(ii)CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
根据盖斯定律可知i+ii得C(s)+H2O(g)=CO(g)+H2(g)△H=+172.5kJ•mol-1-41.0kJ•mol-1=+131.5kJ•mol-1>0,反应S>0,高温时G=△H-T•△S<0反应自发,故答案为:高温;
②A.混合气体的密度不变等于质量和体系体积的比值,反应前后气体的质量变化,体积不变,所以密度变化,密度不变的状态是平衡状态,故正确;
B.反应前后气体的物质的量变化,当该容器内气体的总压强不变的状态是平衡状态,故正确;
C.相同时间内生成H2的量与消耗了的 H2O 的量相等,不能说明正逆反应速率相等,不一定平衡,故错误;
D.CO的体积分数不变的状态是平衡状态的特征之一,故正确.
故选ABD;
(2)①反应(ii)平衡常数表达式:Kc=$\frac{[C{H}_{3}OH]}{[CO]•[{H}_{2}]^{2}}$,故答案为:$\frac{[C{H}_{3}OH]}{[CO]•[{H}_{2}]^{2}}$;
②150℃时,Q点比R点对应的CO的转化率大,平衡正向移动CO的转化率增大,而压强增大,CO(g)+2H2(g)?CH3OH(g)的平衡正向移动,说明P1>P2;Kp只受温度的影响,Q点和R点对应的温度都是150℃,因此Kc(Q)=Kc(R),
故答案为:小于;等于;
③反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变,对应的图象为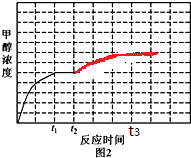 ,故答案为:
,故答案为: .
.
点评 本题考查了化学反应进行的方向和化学平衡,综合性较强,难度较大,题材背景新,侧重于学生对化学反应原理、变通能力的考查.

| A. | 还原剂 | B. | 氧化剂 | C. | 反应物 | D. | 催化剂 |
| A. | 气体分子间平均距离 | B. | 气体分子数目 | ||
| C. | 气体分子本身的体积 | D. | 气体相对分子质量 |
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
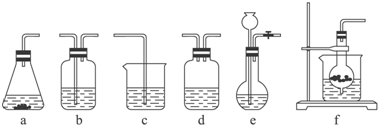
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,Y装置中除去的杂质为HCl.
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3.
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过4.37%(质量分数).
附:有关物质在常温(25℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
| A. | 都是共价化合物 | |
| B. | SiO2可用于制光导纤维,干冰可用于人工降雨 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | 都是酸性氧化物,都能与强碱溶液反应 |
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后pH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol/L | |
| C. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 | |
| D. | 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 简单离子的半径:E>F>C>D | |
| B. | 分子AC2中各原子最外层均满足8电子结构 | |
| C. | 由D、F组成的盐溶液蒸干后可以得到原溶质 | |
| D. | 元素B的最高价氧化物对应的水化物与其氢化物可以反应生成一种盐 |
| A. | 稀硫酸、氢氧化钠溶液能导电,所以它们都是电解质 | |
| B. | 电解质溶液通电时,电解质才能发生电离 | |
| C. | 水溶液能导电的化合物不一定是电解质 | |
| D. | 难溶物质肯定不是电解质 |