题目内容
15.下列有关电解质的说法,正确的是( )| A. | 稀硫酸、氢氧化钠溶液能导电,所以它们都是电解质 | |
| B. | 电解质溶液通电时,电解质才能发生电离 | |
| C. | 水溶液能导电的化合物不一定是电解质 | |
| D. | 难溶物质肯定不是电解质 |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.
非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等.
解答 解:A.电解质都是化合物,稀硫酸、氢氧化钠溶液是混合物,因此不属于电解质,故A错误;
B.电解质溶于水后,在水溶液中自发电离生成自由移动的离子,从而能导电,与是否通电无关,故B错误;
C.有些化合物与水反应生成电解质,但本身不能电离,这些化合物本身并不属于电解质,如CO2、SO2、SO3、NH3等,故C正确;
D.一种物质是否为电解质与其溶解性无关,只与电离程度有关某些化合物如BaSO4、AgCl等,虽然溶解度很小,但由于其溶于水的部分可以完全电离,所以这些物质都是电解质.故D错误,
故选C.
点评 本题考查电解质与非电解质,注意二者均为化合物,特别注意电解质发生电离的为其本身,选项B为学生解答的易错点,难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
3.某校化学兴趣小组的同学对以下三种品牌牙膏中摩擦剂成分进行调查,结果如下表:
请回答下列问题:
(1)上述三种摩擦剂中属于氧化物的是SiO2(填化学式,下同);
(2)青蛙儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)从摩擦剂成分考虑,向佳洁士盐白牙膏样品中滴加少量稀盐酸,可以观察到的现象是有气体生成,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;
(4)中华透明牙膏摩擦剂二氧化硅是工业制备晶体硅的原料.工业制备晶体硅的反应原理是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑(用化学反应方程式表示).
| 牙膏品牌 | 青蛙儿童牙膏 | 佳洁士盐白牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
(1)上述三种摩擦剂中属于氧化物的是SiO2(填化学式,下同);
(2)青蛙儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)从摩擦剂成分考虑,向佳洁士盐白牙膏样品中滴加少量稀盐酸,可以观察到的现象是有气体生成,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;
(4)中华透明牙膏摩擦剂二氧化硅是工业制备晶体硅的原料.工业制备晶体硅的反应原理是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑(用化学反应方程式表示).
20.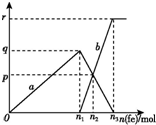 含有1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( )
含有1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( )
 含有1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( )
含有1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( )| A. | a是Fe(NO3)2 | B. | n1=0.375 | C. | p=0.125 | D. | n2=0.30 |
7.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如表所示数据(盐酸的物质的量浓度相等),下列分析推理不正确的是( )
| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
4.用铝片与稀硫酸反应制取氢气时,下列措施一定能使氢气生成速率加大的是( )
| A. | 不用铝片,改用铝粉 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 不用稀硫酸,改用浓硝酸 | D. | 加入少量稀盐酸 |
19.为提纯下列物质(括号中为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 除杂试剂 | 分离方法 | |
| A | 碳酸氢钠(碳酸钠) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氧化铁(氧化铝) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |