题目内容
20.下列关于SiO2和CO2的叙述中不正确的是( )| A. | 都是共价化合物 | |
| B. | SiO2可用于制光导纤维,干冰可用于人工降雨 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | 都是酸性氧化物,都能与强碱溶液反应 |
分析 A.共价化合物是不同非金属原子间利用共用电子对而形成的.共价化合物只含有共价键;
B.干冰可用于人工降雨;
C.二氧化硅不溶于水;
D.氧化物能和碱反应生成盐和水的化合物为酸性氧化物.
解答 解:A.SiO2和CO2只含有共价键,都是共价化合物,故A正确;
B.光导纤维的主要成分是二氧化硅,干冰可用于人工降雨,故B正确;
C.二氧化硅不溶于水,不与水反应,故C错误;
D.CO2和SiO2均能和碱反应生成盐和水,属于酸性氧化物,所以都能与强碱溶液反应,故D正确;
故选C.
点评 本题考查了二氧化碳和二氧化硅的性质,难度不大,注意二氧化硅不溶于水,不与水反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列实验装置制取的是( )
| A. |  实验室制氨气 | B. |  实验室制乙烯 | ||
| C. |  实验室制氯气 | D. |  实验室制乙酸乙酯 |
11.浩瀚的海洋中蕴藏着丰富的资源,海水中含量最多的氯化物是( )
| A. | NaCl | B. | MgCl2 | C. | KCl | D. | CaCl2 |
8.某课题小组研究“铁及其化合物性质”时,向 FeSO4 溶液中滴加少量KSCN溶液,无明显现象.再滴加 H2 O2 溶液时,发现:随着H 2O 2量的增加,溶液先变红,后褪色,并有气泡产生.为弄清楚产生这种异常现象的原因,他们进行了如下探究.
[提出假设]
假设一:产生的气体可能是O 2.
假设二:产生的气体可能是N2、SO 2、CO 2 等气体.
(1 )请写出H2O 2氧化FeSO4的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
[实验设计]
为验证假设二是否成立,课题小组设计如下实验来验证气体成分.
所用试剂:H 2 O2 溶液、FeCl 2 溶液、KSCN 溶液、品红溶液、酸性高锰酸钾溶液、澄清石灰水、NaOH 溶液等.

请完成下表中的内容:
[思考与交流]
(4 )根据题目中所给的信息及实验推断出物质还原性的强弱顺序:Fe2+>SCN-(填“>”或“<”),理由是向FeCl2和KSCN混合液中加入少量双氧水,溶液先变红,说明双氧水优先氧化Fe2+.
(5 )有同学认为:KSCN 被氧化的产物中可能还含有 SO 42-,请设计一个简单实验验证.
[提出假设]
假设一:产生的气体可能是O 2.
假设二:产生的气体可能是N2、SO 2、CO 2 等气体.
(1 )请写出H2O 2氧化FeSO4的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
[实验设计]
为验证假设二是否成立,课题小组设计如下实验来验证气体成分.
所用试剂:H 2 O2 溶液、FeCl 2 溶液、KSCN 溶液、品红溶液、酸性高锰酸钾溶液、澄清石灰水、NaOH 溶液等.

请完成下表中的内容:
| 实验过程和现象 | 结论 |
| (2)试管A中盛有品红溶液现象:品红溶液褪色 | 证明气体中含有SO2 |
| (3)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅试管C中现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
(4 )根据题目中所给的信息及实验推断出物质还原性的强弱顺序:Fe2+>SCN-(填“>”或“<”),理由是向FeCl2和KSCN混合液中加入少量双氧水,溶液先变红,说明双氧水优先氧化Fe2+.
(5 )有同学认为:KSCN 被氧化的产物中可能还含有 SO 42-,请设计一个简单实验验证.
| 实验过程 | 实验现象及结论 |
15.下列实验操作中,正确的是( )
| A. |  点燃酒精灯 | B. |  检查气密性 | C. |  读取液体体积 | D. |  加热液体 |
9.现有三种有机化合物的分子式:①C5H12②C3H6Cl2③C5H10则它们的链状同分异构体数由多到少的顺序为( )
| A. | ③>②>① | B. | ②>①>③ | C. | ①>②>③ | D. | ②>③>① |
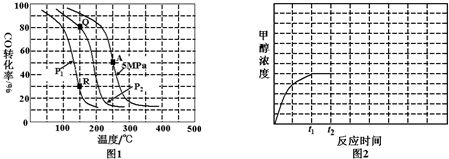
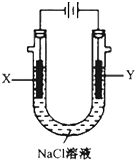 甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.