题目内容
要求回答下列各题.
(1)写出下列物质的路易斯结构式.
POCl3: HOCN:
(2)用价层电子对互斥模型预测SO2Cl2、ICl4-的立体结构,并给出中心原子的氧化数和杂化轨道类型.
(3)写出下列粒子中的Π键类型.(例如CO2:
)
O3: SO3: .
(1)写出下列物质的路易斯结构式.
POCl3:
(2)用价层电子对互斥模型预测SO2Cl2、ICl4-的立体结构,并给出中心原子的氧化数和杂化轨道类型.
| 粒子 | 立体结构 | 中心原子 氧化数 | 中心原子 杂化轨道类型 |
| SO2Cl2 | |||
| ICl4- |
| 2π | 4 3 |
O3:
考点:判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据路易斯结构式的表示方法解答,路易斯结构式需标示孤对电子存在;
(2)根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=
×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,进行分析判断,氧化数指的是该原子被氧化的程度;
(3)当两个原子的p轨道从垂直于成键原子的核间连线的方向接近,发生电子云重叠而成π键.π键通常伴随σ键出现,O3是三中心四电子π键,SO3是四中心六电子π键;
(2)根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=
| 1 |
| 2 |
(3)当两个原子的p轨道从垂直于成键原子的核间连线的方向接近,发生电子云重叠而成π键.π键通常伴随σ键出现,O3是三中心四电子π键,SO3是四中心六电子π键;
解答:
解:(1)磷原子最外层5个电子,氯原子最外层7个电子,氧原子最外层6个电子,POCl3中氧原子和氯原子分别有3对孤电子对,磷原子无孤对电子,所以POCl3的路易斯结构式为: ;
;
氢原子最外层1个电子,氧原子最外层6个电子,碳原子最外层4个电子,氮原子最外层5个电子,HOCN中氢原子无孤对电子,氧原子有2对孤电子对,氮原子有1对孤对电子,所以HOCN的路易斯结构式为: ,
,
故答案为: ;
; ;
;
(2)SO2Cl2中心原子为硫原子,电负性O>Cl>S,所以S氧化数为+6,价层电子对个数=σ键个数+孤电子对个数=4+0=4,sp3杂化,立体结构为四面体型;
ICl4-中心原子为I原子,电负性Cl>I,所以I氧化数为+3,价层电子对个数=σ键个数+孤电子对个数=4+
=6,为sp3d2杂化,立体结构为平面正方形;
故答案为:
(3)O3折线型分子,中间的O原子sp2杂化,提供1个未参与杂化的p轨道,上面有2个电子,两边的O原子则各提供1个未成对电子,所以形成了3原子4电子的大π键
;
SO3中,S元素采取sp2杂化,在竖直方向上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键,2个氧原子竖直方向上p轨道各有1个电子,一个氧原子与杂化轨道的孤对电子形成配位键,其竖直方向上有2个电子,在4个原子的竖直方向的电子共同形成离域的四中心六电子
;
故答案为:
;
;
 ;
;氢原子最外层1个电子,氧原子最外层6个电子,碳原子最外层4个电子,氮原子最外层5个电子,HOCN中氢原子无孤对电子,氧原子有2对孤电子对,氮原子有1对孤对电子,所以HOCN的路易斯结构式为:
 ,
,故答案为:
 ;
; ;
;(2)SO2Cl2中心原子为硫原子,电负性O>Cl>S,所以S氧化数为+6,价层电子对个数=σ键个数+孤电子对个数=4+0=4,sp3杂化,立体结构为四面体型;
ICl4-中心原子为I原子,电负性Cl>I,所以I氧化数为+3,价层电子对个数=σ键个数+孤电子对个数=4+
| 8-4 |
| 2 |
故答案为:
| 粒子 | 立体结构 | 中心原子 氧化数 | 中心原子 杂化轨道类型 |
| SO2Cl2 | 四面体型 | +6 | sp3 |
| ICl4- | 平面正方形 | +3 | sp3d2 |
| π | 4 3 |
SO3中,S元素采取sp2杂化,在竖直方向上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键,2个氧原子竖直方向上p轨道各有1个电子,一个氧原子与杂化轨道的孤对电子形成配位键,其竖直方向上有2个电子,在4个原子的竖直方向的电子共同形成离域的四中心六电子
| π | 6 4 |
故答案为:
| π | 4 3 |
| π | 6 4 |
点评:本题考查了路易斯结构式、氧化数和杂化轨道类型、键类型等知识点,题目难度较大,充分考查了学生对物质结构知识的掌握情况,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
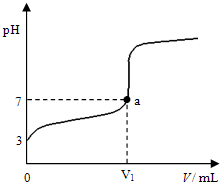 某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )
某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )| A、该温度下醋酸的电离平衡常数约为1×10-5mol?L-1 |
| B、图中V1>20mL,且a点对应的溶液中:c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| C、图中V1<20mL,且a点对应的溶液中:c (CH3COOH)+c (CH3COO-)>c (Na+) |
| D、当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH)+c (H+)>c (OH-) |
在1L定容的密闭容器中,可以证明可逆反应N2+3H2? 2NH3 已达到平衡状态的是( )
| A、c(N2):c(H2):c(NH3)=1:3:2 |
| B、一个N≡N 断裂的同时,有3个H-H生成 |
| C、其他条件不变时,混合气体的密度不再改变 |
| D、v正(N2)═2 v逆(NH3) |