题目内容
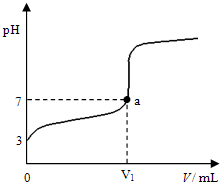 某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )
某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )| A、该温度下醋酸的电离平衡常数约为1×10-5mol?L-1 |
| B、图中V1>20mL,且a点对应的溶液中:c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| C、图中V1<20mL,且a点对应的溶液中:c (CH3COOH)+c (CH3COO-)>c (Na+) |
| D、当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH)+c (H+)>c (OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.0.1mol?L-1 CH3COOH溶液的pH=3,则c(CH3COO-)≈c(H+)=10-3mol?L-1,根据醋酸的电离平衡常数表达式进行计算;
B.没有告诉温度,无法判断溶液酸碱性及加入氢氧化钠溶液体积;
C.不知道温度,无法判断加入氢氧化钠溶液的体积;
D.溶液中一定满足质子守恒,根据质子守恒进行判断.
B.没有告诉温度,无法判断溶液酸碱性及加入氢氧化钠溶液体积;
C.不知道温度,无法判断加入氢氧化钠溶液的体积;
D.溶液中一定满足质子守恒,根据质子守恒进行判断.
解答:
解:A.根据图象可知,0.1mol?L-1 CH3COOH溶液的pH=3,则c(CH3COO-)≈c(H+)=10-3mol?L-1,该温度下醋酸的电离平衡常数为:K=
=
=1×10-5mol?L-1,故A正确;
B.由于不知道温度,无法判断a点pH=7时溶液的酸碱性,无法判断加入氢氧化钠溶液的体积,故B错误;
C.没有告诉温度,无法判断pH=7时溶液的酸碱性,则无法判断加入氢氧化钠溶液的体积,故C错误;
D.溶液中水电离的氢离子与氢氧根离子浓度一定相等,即一定满足质子守恒,c(CH3COOH)+c (H+)=c (OH-),故D错误;
故选A.
| c(H+)c(CH3COO-) |
| c(CH3COOH) |
| 10-3×10-3 |
| 0.1 |
B.由于不知道温度,无法判断a点pH=7时溶液的酸碱性,无法判断加入氢氧化钠溶液的体积,故B错误;
C.没有告诉温度,无法判断pH=7时溶液的酸碱性,则无法判断加入氢氧化钠溶液的体积,故C错误;
D.溶液中水电离的氢离子与氢氧根离子浓度一定相等,即一定满足质子守恒,c(CH3COOH)+c (H+)=c (OH-),故D错误;
故选A.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合的定性判断方法,本题中需要注意温度不确定,无法判断pH=7时溶液酸碱性,为易错点.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
镧(La)是一种活泼性比锌更强的稀土元素,它的氧化物分子式La2O3,La(OH)3是不溶于水的碱;而LaCl3、La(NO3)3都溶于水.现有下列几种组合
(1)La2O3+HCl
(2)La+HCl
(3)La(OH)3+HCl
(4)NaCl+La(OH)3
(5)La+Cl2 (6)La2O3+KCl
能直接制得LaCl3的反应是( )
(1)La2O3+HCl
(2)La+HCl
(3)La(OH)3+HCl
(4)NaCl+La(OH)3
(5)La+Cl2 (6)La2O3+KCl
能直接制得LaCl3的反应是( )
| A、(1)(2)(3)(4) |
| B、(1)(2)(3)(5) |
| C、(2)(3)(5)(6) |
| D、(1)(2)(3)(4)(5) |
常温下,向0.1mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液(装置如图1),生成沉淀的量与加入氢氧化钡溶液的体积关系如图2所示,a、b、c、d分别表示实验的不同阶段,下列有关说法中不正确的是( )
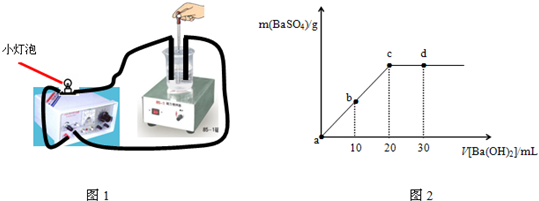

| A、实验过程中小灯泡由亮逐渐变暗直至熄灭,后又逐渐变亮 |
| B、实验中反应发生的条件是有难溶物质和难电离物质生成 |
| C、溶液的pH值:a<b<c<d |
| D、小灯泡的亮度:a>b=d>c |
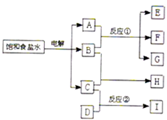 如图所示,每一方框中的字母各代表一种反应物或生成物:
如图所示,每一方框中的字母各代表一种反应物或生成物:物质A跟B反应生成物质E、F和G;物质C跟D在2L的反应容器中生成物质I,某温度下该反应起始时刻试剂的反应混合物组成如下表格所示,且D、I在常温下均为气体,
| C | D | I | |
| 起始组成/mol | 6 | 4 | 0 |
| 平衡组成/mol | 3 | 3 | 1 |
| A、物质H的化学式是HCl | ||
| B、反应①的化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O | ||
C、反应②的平衡常数等于
| ||
| D、电解饱和食盐水的阴极可以是铁棒,阳极可以是碳棒或铁棒 |
下列实验操作或对实验事实的描述不正确的是( )(填序号).
| A、用分液漏斗进行分液操作,将甘油和水的混合物分离 |
| B、从溴的四氯化碳溶液中提取溴,可用苯进行萃取 |
| C、用热的浓HCl洗涤附着有MnO2的试管 |
| D、在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 |
| E、用碱式滴定管量得KMnO4溶液20.50mL |
| F、实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置 |
| G、只用水一种试剂就能将CuSO4、Na2CO3、CaC2三种固体粉末鉴别 |
| H、用NaOH溶液和FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管插入FeSO4溶液中 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1 mol?L-1甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、10mL 1 mol?L-1甲酸恰好与10mL 1 mol?L-1NaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比醋酸溶液强 |
将0.2mol/L的醋酸钠溶液10mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A、c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| B、c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) |
| C、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| D、c(CH3COO-)═c(Cl-)═c(CH3COOH)>c(H+) |