题目内容
(1)同温同压下,同体积的H2和CO2物质的量之比为 ,密度之比为 .
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是 (用含NA的式子表示).
(3)配制100mL 1mol?L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g?mL-1,质量分数为98%)的体积为 mL.
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是
(3)配制100mL 1mol?L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g?mL-1,质量分数为98%)的体积为
考点:物质的量的相关计算,溶液的配制
专题:计算题
分析:(1)根据阿伏加德罗定律可知:同温同压下等体积的H2和CO2的物质的量相同,同温同压下,气体的密度与摩尔质量成正比;
(2)正确理解气体摩尔体积,阿伏加德罗常数,先求出ag氧气含有的分子数,再求出其物质的量,最后根据气体体积公式求出体积;
(3)根据稀释前后溶质的物质的量不变计算浓硫酸的体积;
(2)正确理解气体摩尔体积,阿伏加德罗常数,先求出ag氧气含有的分子数,再求出其物质的量,最后根据气体体积公式求出体积;
(3)根据稀释前后溶质的物质的量不变计算浓硫酸的体积;
解答:
解:(1)根据阿伏加德罗定律可知:同温同压下等体积的H2和CO2的物质的量相同,则比值都为1:1,同温同压下,气体的密度与摩尔质量成正比;即ρ(H2):ρ(CO2)=M(H2):M(CO2)=2:44=1:22;
故答案为:1:1;1:22;
(2)根据其组分都为氧气相同,所以其质量与分子数成正比,ag氧气含有的分子数为:b个,质量与分子数的比列式为:ag:b个=cg:x个,
x=
个;
cg该混合气体含有的物质的量为:n=
=mol其体积为:V=n×Vm =
mol×Vm =
L
故答案为:
L;
(3))该浓H2SO4的物质的量浓度为:c=
=
mol/L=18.4 mol/L.据稀释定律得:100 mL×1 mol/L=18.4 mol/L×V,
得V=5.4 mL,
故答案为:5.4;
故答案为:1:1;1:22;
(2)根据其组分都为氧气相同,所以其质量与分子数成正比,ag氧气含有的分子数为:b个,质量与分子数的比列式为:ag:b个=cg:x个,
x=
| bc |
| a |
cg该混合气体含有的物质的量为:n=
| bc |
| a?NA |
| bc |
| a?NA |
| 22.4bc |
| a?NA |
故答案为:
| 22.4bc |
| a?NA |
(3))该浓H2SO4的物质的量浓度为:c=
| 1000ml/L×ρ×w |
| M |
| 1000×1.84×98% |
| 98 |
得V=5.4 mL,
故答案为:5.4;
点评:本题考查了物质的量的有关计算及阿伏加德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积、物质的量浓度之间的计算公式的运用,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1 mol?L-1甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、10mL 1 mol?L-1甲酸恰好与10mL 1 mol?L-1NaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比醋酸溶液强 |
有机物 的一元取代产物有( )
的一元取代产物有( )
 的一元取代产物有( )
的一元取代产物有( )| A、8神 | B、6种 | C、4种 | D、3种 |
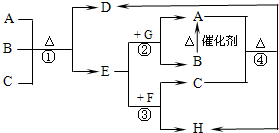 如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.
如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.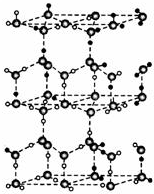 水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.
水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.