题目内容
某气体A可从石油中获得,是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平;气体A又可作为水果的催熟剂.
(1)A的结构简式是
(2)A分子间的相互加成所形成的高分子化合物是日常生活中的一种常用材料,其合成方程式是
(3)以A为原料 (无机物任选),还可以合成酯,写出相关的化学方程式 .
(1)A的结构简式是
(2)A分子间的相互加成所形成的高分子化合物是日常生活中的一种常用材料,其合成方程式是
(3)以A为原料 (无机物任选),还可以合成酯,写出相关的化学方程式
考点:乙烯的化学性质,乙烯的用途
专题:有机物的化学性质及推断
分析:(1)乙烯工业的发展,带动了其他以石油为原料的石油化工的发展,因此一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志,则A为乙烯,乙烯分子中含有碳碳双键;
(2)乙烯分子中含有碳碳双键,在催化剂作用下可以发生加成反应是聚乙烯;
(3)乙烯与水在催化剂存在条件下反应生成乙醇,乙醇催化氧化生成乙酸,乙酸与乙醇反应生成乙酸乙酯和水,据此写出反应的化学方程式.
(2)乙烯分子中含有碳碳双键,在催化剂作用下可以发生加成反应是聚乙烯;
(3)乙烯与水在催化剂存在条件下反应生成乙醇,乙醇催化氧化生成乙酸,乙酸与乙醇反应生成乙酸乙酯和水,据此写出反应的化学方程式.
解答:
解:(1)根据“A可从石油中获得,是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平;气体A又可作为水果的催熟剂”可知,气体A为乙烯,乙烯的结构简式为:CH2=CH2,
故答案为:CH2=CH2;
(2)乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯,反应的化学方程式为: ,
,
故答案为: ;
;
(3)CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2O
CH3CH2OH,
乙醇在在催化剂存在条件下加热可以生成乙酸,反应的化学方程式为:2CH3CH2OH+O2
2CH3CHO+H2O,
乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2,
故答案为:CH2=CH2+H2O
CH3CH2OH、2CH3CH2OH+O2
2CH3CHO+H2O、CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2.
故答案为:CH2=CH2;
(2)乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯,反应的化学方程式为:
 ,
,故答案为:
 ;
;(3)CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2O
| 催化剂 |
乙醇在在催化剂存在条件下加热可以生成乙酸,反应的化学方程式为:2CH3CH2OH+O2
| 催化剂 |
| △ |
乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH
| 浓硫酸 |
| △ |
故答案为:CH2=CH2+H2O
| 催化剂 |
| 催化剂 |
| △ |
| 浓硫酸 |
| △ |
点评:本题考查了乙烯的组成、结构与性质,题目难度不大,注意掌握乙烯的分子组成及具有的化学性质,能够正确书写常见有机反应的化学方程式,明确“产量可以用来衡量一个国家的石油化工水平”的是乙烯为解答的突破口.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
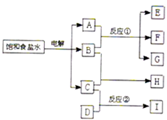 如图所示,每一方框中的字母各代表一种反应物或生成物:
如图所示,每一方框中的字母各代表一种反应物或生成物:物质A跟B反应生成物质E、F和G;物质C跟D在2L的反应容器中生成物质I,某温度下该反应起始时刻试剂的反应混合物组成如下表格所示,且D、I在常温下均为气体,
| C | D | I | |
| 起始组成/mol | 6 | 4 | 0 |
| 平衡组成/mol | 3 | 3 | 1 |
| A、物质H的化学式是HCl | ||
| B、反应①的化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O | ||
C、反应②的平衡常数等于
| ||
| D、电解饱和食盐水的阴极可以是铁棒,阳极可以是碳棒或铁棒 |