题目内容
19.下列物质对应的电子式书写正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A.铵根离子书写错误,氮原子与氢原子之间存在N-H键;
B.氯离子为应用中括号括起来;
C.氮气中存在三对共用电子对,还有2个未成对电子;
D.过氧化钠为离子化合物,2个钠离子与过氧根离子之间通过离子键结合,两个氧原子通过共用电子对结合;
解答 解:A.NH4Br为离子化合物,由氨根离子与溴离子构成,电子式为: ,故A错误;
,故A错误;
B.CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,故B错误;
,故B错误;
C.氮气中存在三对共用电子对,还有2个未成对电子,电子式为 ,故C错误;
,故C错误;
D.Na2O2是离子化合物,由钠离子与过氧根离子构成,电子式为: ,故D正确;
,故D正确;
故选:D.
点评 本题考查电子式的书写,难度不大,注意电子式中的电子数是指最外层电子数,而不是指电子总数,阴离子要写出离子的电子分布并加上括号和电荷.

练习册系列答案
相关题目
10.常温某无色溶液中,由水的电离产生的C(H+)=1×10-12mol/L,则下列肯定能共存的离子组是( )
| A. | Cu2+ NO3- SO42- Fe3+ | |
| B. | Cl- S2- Na+ K+ | |
| C. | Cl- Na+ NO3- SO42- | |
| D. | SO32- NH4+ K+ Mg2+ |
7.已知2SO2(g)+O2(g)?2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%.若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
| A. | 10mol 10% | B. | 20mol 20% | C. | 20mol 40% | D. | 30mol 80% |
14.温度为500℃时,反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率为( )
| A. | v(O2)=0.01 mol/(L•s) | B. | v(NO)=0.08 mol/(L•s) | ||
| C. | v(H2O)=0.03 mol/(L•s) | D. | v(NH3)=0.002 mol/(L•s) |
8.下列实验操作、现象和结论有不正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入含紫色石蕊试液的水中 | 溶液先变红后褪色 | SO2有漂白性 |
| B | 将纯Fe(NO3)2样品溶于稀H2SO4中,滴加KSCN溶液 | 溶液变红 | HNO3氧化性强于Fe3+的氧化性 |
| C | 将新制氯水和KI溶液在试管中混合后,加入CCl4,振荡静置 | 溶液分层,下层呈紫色 | 非金属性:Cl>I |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质中既有离子键又有共价键的是 ( )
| A. | MgO | B. | NaOH | C. | CaCl2 | D. | CO2 |
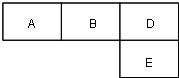 M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.
M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.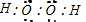 .
.