题目内容
19.取100mLNa2CO3和Na2SO4的混合液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出.试计算:(1)原混合物中Na2CO3和Na2SO4的物质的量浓度.
(2)产生的气体在标准状况下的体积.
分析 (1)14.51g白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与硝酸,BaCO3溶于硝酸,故白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g为BaSO4的质量,可得BaCO3的质量为14.51g-4.66g=9.85g,根据n=$\frac{m}{M}$计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c=$\frac{n}{V}$计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.
解答 解:(1)14.51g白色沉淀是BaCO3和BaSO4混合物,加入过量的稀HNO3,充分反应后,剩余沉淀4.66g为BaSO4,BaSO4的物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为:$\frac{0.02mol}{0.1L}$=0.2mol/L,
减少的沉淀质量为BaCO3,则BaCO3的质量为:14.51g-4.66g=9.85g,物质的量为:$\frac{9.85g}{197g/mol}$=0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为:$\frac{0.05mol}{0.1L}$=0.5mol/L,
答:原混和溶液中Na2SO4和Na2CO3的物质的量浓度分别为0.2mol/L、0.5mol/L;
(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知生成二氧化碳气体的物质的量为:n(CO2)=n(BaCO3)=0.05mol,
则生成的二氧化碳的体积为:0.05mol×22.4L/mol=1.12L,
答:产生的气体在标准状况下的体积为1.12L.
点评 本题考查混合物的有关计算,题目难度不大,明确发生反应的原理为解答关键,注意守恒思想的运用,试题培养了学生的分析能力及化学计算能力.

| A. | 消石灰 | B. | 稀硫酸 | C. | 无水硫酸铜 | D. | 金属钠 |
供选择的化学试剂及实验方法
A.氯化钡溶液
B.将溶液滴在pH试纸上
C.加入Na2CO3溶液,观察现象
D.加入足量铁粉,过滤
E.硫氰酸钾(KSCN)溶液
| 实验要求 | 选项的标号 |
| (1)证明粗盐中含有少量CaCl2 | |
| (2)鉴别Na2SO4溶液和NaCl溶液 | |
| (3)检验氯化亚铁是否变质 | |
| (4)证明某地雨水溶液呈酸性 | |
| (5)除去FeCl2溶液中的少量FeCl3 | 1 |
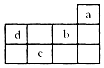
| A. | a原子最外电子层上的电子数为8 | |
| B. | b的最高价氧化物对应水化物为强酸 | |
| C. | c存在的两种常见氧化物分子组成上相差一个氧原子 | |
| D. | d和b都是第二周期的非金属元素,且d比b的非金属性强 |
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
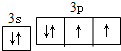 .
.
 .(以上均用元素符号表示)
.(以上均用元素符号表示)