题目内容
1.天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4.
写出CO与H2反应生成CH4和H2O的热化学方程式CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-203kJ•mol-1
已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式2NH4HS+O2=2NH3•H2O+2S↓.
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)═2CO(g)+2H2(g).
在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生
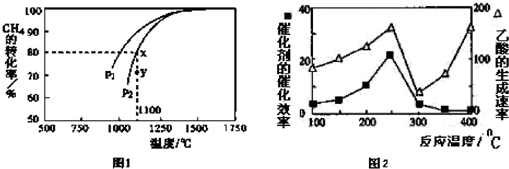
反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1小于P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”). 求Y点对应温度下的该反应的平衡常数K=1.6.(计算结果保留两位有效数字)
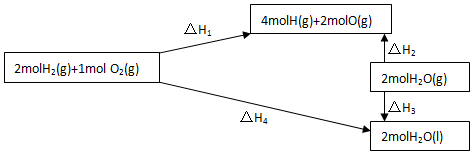
(4)以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4 和CO2直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度高于250℃时,催化剂的活性降低,使催化效率下降.
②为了提高该反应中CH4的转化率,可以采取的措施是增大CO2的浓度或及时分离出乙酸.
分析 (1)根据盖斯定律书写目标热化学方程式;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;根据转化率计算平衡时各物质的平衡浓度,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到平衡常数;
(4)①催化剂活性越大,反应速率越大,温度过高,催化剂的活性降低;
②为了提高该反应中的CH4转化率,可以使平衡正向移动.
解答 解:(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①得:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-203kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-203kJ•mol-1;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质,则一定条件下向NH4HS溶液中通入空气,得到单质硫和氨水,则反应方程式为:2NH4HS+O2=2NH3•H2O+2S↓,
故答案为:2NH4HS+O2=2NH3•H2O+2S↓;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2,压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
在Y点对应温度下的甲烷的平衡转化率为80%,则
CO2(g)+CH4(g)?2CO(g)+2H2(g)
起始(mol/L) 0.1 0.1 0 0
转化(mol/L)0.08 0.08 0.16 0.16
平衡(mol/L)0.02 0.02 0.16 0.16
所以平衡常数K=$\frac{{0.16}^{2}×0.1{6}^{2}}{0.02×0.02}$=1.6;
故答案为:小于;大于;1.6;
(4)①由于250℃是Cu2Al2O4催化剂的活性温度,所以在250℃时催化剂活性最大,反应速率大,温度250~300℃时,催化剂的活性降低,使催化效率下降,
故答案为:温度高于250℃时,催化剂的活性降低,使催化效率下降;
②平衡正向移动,CH4转化率增大,增大CO2的浓度或及时分离出乙酸,平衡正向移动,
故答案为:增大CO2的浓度或及时分离出乙酸.
点评 本题考查了化学平衡常数的计算、盖斯定律的应用、平衡的移动等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 2.93g | B. | 3.51g | C. | 4.00g | D. | 5.85g |
| A. | 将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L | |
| B. | 配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL | |
| C. | 0.270 kg质量分数为10%的CuCl2溶液中Cl-的物质的量为0.2 mol | |
| D. | 80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L |
| A. | a:b=3:1 | |
| B. | X、Y的转化率相等 | |
| C. | Y和Z的生成速率之比为2:3可做平衡标志 | |
| D. | a的取值范围为0 mol•L-1<a<0.18 mol•L-1 |
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 盐酸与碳酸钠溶液反应CO32-+2H+═CO2↑+H2O | |
| C. | 硝酸银溶液中加入铜粉Ag++Cu═Cu2++Ag | |
| D. | 铁与稀盐酸反应2Fe+6H+═2Fe3++3H2↑ |
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应: