题目内容
15.下列实验装置或操作正确的是( )| A | B | C | D |
 |  |  |  |
| 向容量瓶中转移液体 | 实验室制取乙酸乙酯 | 实验室制乙烯 | 分离酒精和水 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.转移液体需要引流,玻璃棒下端在刻度线下;
B.导管在碳酸钠溶液的液面下,可发生倒吸;
C.乙醇在170℃发生消去反应生成乙烯;
D.酒精和水互溶.
解答 解:A.转移液体需要引流,玻璃棒下端在刻度线下,图中转移液体的操作合理,故A正确;
B.导管在碳酸钠溶液的液面下,可发生倒吸,应将导管在液面上,故B错误;
C.乙醇在170℃发生消去反应生成乙烯,则温度计应测定液体的温度,故C错误;
D.酒精和水互溶,不能分液分离,应选蒸馏法,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、有机物的制备、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列各组物质发生化学反应时,由于反应物的量不同而导致生成不同产物的是( )
①CO2与NaOH溶液
②盐酸溶液与偏铝酸钠溶液
③NaHCO3溶液与盐酸
④高温下焦炭与O2
⑤AlCl3溶液与氢氧化钠溶液
⑥铁与稀硝酸.
①CO2与NaOH溶液
②盐酸溶液与偏铝酸钠溶液
③NaHCO3溶液与盐酸
④高温下焦炭与O2
⑤AlCl3溶液与氢氧化钠溶液
⑥铁与稀硝酸.
| A. | 除②外 | B. | 除③外 | C. | 除②③⑤⑥外 | D. | 除③⑥外 |
19.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为5:2.Z原子比X原子的核外电子数多5.下列说法正确的是( )
| A. | W、Y的最高价氧化物都是气体 | |
| B. | Y、Z形成的化合物一定为共价化合物 | |
| C. | 四种元素中W元素的非金属性最强 | |
| D. | W、X、Y、Z的原子半径大小顺序一定是:Z>Y>X>W |
3.根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1
(ⅱ)I2(s)+H2(g)?HI(g)△H=+26.48kJ•mol-1
下列判断正确的是( )
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1
(ⅱ)I2(s)+H2(g)?HI(g)△H=+26.48kJ•mol-1
下列判断正确的是( )
| A. | 1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定 |
20.向50mL14.0mol•L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应的铜的质量为( )
| A. | 6.4g | B. | 12.8g | C. | 19.2g | D. | 38.4g |
7.下列说法正确的是( )
| A. | lmol Na2O2与足量水反应后产生氧气,理论上转移的电子数为2×6.02×1023 | |
| B. | SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 稀释0.1 mol•L-1CH3COOH溶液,溶液中所有离子浓度均减小 | |
| D. | 铅蓄电池在充电过程中,两极质量都增大 |
4.下列关于实验事故或药品的处理方法中,正确的是( )
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 实验室的废酸废碱可用中和法来处理 | |
| C. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 | |
| D. | 金属钠着火时,可立即用沾水的毛巾覆盖 |
5.按碳骨架分类,下列说法正确的是( )
| A. | CH3CH(CH3)2 属于链状化合物 | B. | 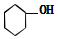 属于酚类化合物 | ||
| C. | 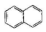 属于苯的同系物 | D. | 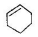 属于芳香族化合物 |