题目内容
3.根据碘与氢气反应的热化学方程式(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1
(ⅱ)I2(s)+H2(g)?HI(g)△H=+26.48kJ•mol-1
下列判断正确的是( )
| A. | 1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定 |
分析 A.因为是可逆反应,所以不能进行完全;
B.由盖斯定律知(i)-(ii)得I2(g)=I2(s);
C.对于同一物质,固态物质的能量比气态物质能量低;因此反应(ii)的反应物总能量比反应(i)的反应物总能量低,故C对;
D.能量越低越稳定.
解答 解:A.因为是可逆反应,所以不能进行完全,反应吸热小于26.48 kJ,故A错误;
B.由盖斯定律知(i)-(ii)得,9.48-(-26.48)=35.96kJ,即1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ,故B错误;
C.对于同一物质,固态物质的能量比气态物质能量低;因此反应(ii)的反应物总能量比反应(i)的反应物总能量低,故C正确;
D.反应(ⅰ)和反应(ⅱ)的产物一样,都是HI的气态,稳定性相同,故D错;
故选C.
点评 本题考查了热化学方程式的书写和能量变化的分析判断,特别注意书写热化学方程式注明各物质的状态,计量数可以是分数,根据题意计算反应热,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
7.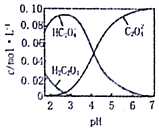 已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
 已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | PH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| C. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| D. | PH=7的溶液中:c(Na+)>2 c(C2O42-) |
4.对二甲苯(PX)是生产矿泉水瓶 (聚对苯二甲酸乙二酯,简称PET)的必要原料,生产涉及的反应之一如下:
5 (PX)+12MnO${\;}_{4}^{-}$+36H+→5
(PX)+12MnO${\;}_{4}^{-}$+36H+→5 (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )
5
 (PX)+12MnO${\;}_{4}^{-}$+36H+→5
(PX)+12MnO${\;}_{4}^{-}$+36H+→5 (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | Mn2+是该反应的还原产物 | |
| B. | PTA 与乙醇通过缩聚反应即可生产 PET塑料 | |
| C. | PX 分子含有苯环的同分异构体还有3种 | |
| D. | 该反应消耗1molPX,共转移12N A个电子 ( NA为阿伏加德罗常数的数值) |
11.己知CO(g)+2H2(g)?CH3OH(g)是煤液化的一个反应,在温度T1和T2时将1molCO和3molH2充入2L密闭容器中测得n(CO)随时间(s)的变化如下表
下列说法正确的是( )
| 温度 n(CO) 时间 | 0 | 10 | 20 | … | 40 | 50 |
| T1 | 1.0 | 0.7 | 0.5 | … | 0.25 | 0.25 |
| T2 | 1.0 | 0.65 | 0.4 | … | 0.28 | 0.28 |
| A. | T1温度下平衡后恒容再充入0.5molCO,重新平衡后CO总的转化率与H2相等 | |
| B. | T1温度下10-20sH2的反应速率为0.04mol•L-1•s-1 | |
| C. | 该反应的△Η>0 | |
| D. | T2温度下平衡后恒定压强不变充入0.28molCH3OH,CH3OH的体积分数不变 |
8.将90g两种物质组成的混合物与足量的盐酸反应,所生成的气体通入足量的Na2O2,Na2O2增重28g,该混合物的成分可能是( )
| A. | Na2CO3和NaHCO3 | B. | Na2CO3和K2CO3 | C. | Ca(HCO3)2和NaHCO3 | D. | CaCO3和Ca(OH)2 |