题目内容
3.NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol/L的Ba(NO3)2溶液中含NO3-离子数为2NA | |
| D. | 分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g |
分析 A、标况下水为液态;
B、NO2和N2O4的最简式均为NO2;
C、溶液体积不明确;
D、气体所处的状态不明确.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含2NA个氧原子,故B正确;
C、溶液体积不明确,故溶液中的硝酸根的个数无法计算,故C错误;
D、气体所处的状态不明确,故气体的体积无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下列关于反应热的说法正确的是( )
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol |
14.某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:

(1)检验如图装置气密性的最简便方法为:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好.
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
(3)该实验探究的是浓度因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是②>①(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0052mol/L(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①该反应为放热反应、②产物Mn2+是反应的催化剂、③K+对该反应有催化作用.
| 实验序号 | A 溶液 | B 溶液 |
| ① | 20 mL 0.1 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1KMnO4 酸性溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好.
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
(3)该实验探究的是浓度因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是②>①(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0052mol/L(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①该反应为放热反应、②产物Mn2+是反应的催化剂、③K+对该反应有催化作用.
11.下列叙述中,不能用勒夏特列原理解释的是( )
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色 | |
| C. | 对2HI(g)?H2(g)+I2(g)平衡体系增大压强使气体颜色变深 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
18.足量的Zn与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但又不影响生成氢气的体积的是( )
| A. | NaOH固体 | B. | Na2CO3固体 | C. | NaCl晶体 | D. | CH3COONa固体 |
8.Fe3O4可表示为FeO•Fe2O3,是一种性能优良的新型磁性材料.水热法制备Fe3O4纳米级颗粒的反应为3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+yH2O.下列说法中,不正确的是( )
| A. | 每生成1mol Fe3O4,反应转移的电子总数为4mol | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为1:5 | |
| C. | 3mol Fe2+被氧化时,消耗O2标准状况下的体积约为22.4L | |
| D. | x=4 |
15.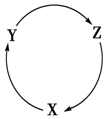 下列各组物质中,满足图中物质一步转化关系的选项是( )
下列各组物质中,满足图中物质一步转化关系的选项是( )
 下列各组物质中,满足图中物质一步转化关系的选项是( )
下列各组物质中,满足图中物质一步转化关系的选项是( )| X | Y | Z | |
| A | CO | CO2 | H2CO3 |
| B | Cu | CuO | Cu(OH)2 |
| C | CaO | Ca(OH)2 | CaCO3 |
| D | H2SO4 | Na2SO4 | NaCl |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法正确的是( )
| A. | 活化分子间的碰撞一定能发生化学反应 | |
| B. | 升高温度时,化学反应速率加快,主要原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 | |
| C. | 自发进行的反应一定迅速 | |
| D. | 凡是熵增加的过程都是自发过程 |