题目内容
18.足量的Zn与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但又不影响生成氢气的体积的是( )| A. | NaOH固体 | B. | Na2CO3固体 | C. | NaCl晶体 | D. | CH3COONa固体 |
分析 反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.加入氢氧化钠,消耗盐酸,生成氢气的总量减少,故A错误;
B.加入碳酸钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故B错误;
C.加入氯化钠,溶液浓度不变,反应速率不变,故C错误;
D.加入醋酸钠,生成醋酸,氢离子浓度降低,反应速率减小,但不影响生成氢气的总量,故D正确.
故选D.
点评 本题考查化学反应速率影响因素,题目难度不大,需注意生成氢气的量不变,注意A选项构成原电池,加快反应速率,明确化学反应速率及其影响因素为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.在容积相同的两个密闭容器M和N中,保持温度为150℃,向M容器中加入a mol HI,同时向N容器中加入b mol HI (a>b).当反应2HI(g)?H2 (g)+I2 (g) 达到平衡后,下列说法正确的是( )
| A. | 从反应开始到达到平衡,所需时间tM>tN | |
| B. | 平衡时cM(I2)=c N(I2) | |
| C. | 平衡时I2 蒸气在混合气体中的体积分数:M>N | |
| D. | HI的平衡分解率αM=αN |
9.3.15g A物质和10.5g B物质完全反应,生成7.2g C物质、1.8g D物质和0.3mol E物质,则E的摩尔质量为( )
| A. | 15.5 g•mol-1 | B. | 85 g•mol-1 | C. | 55 | D. | 55 g•mol-1 |
6.下列说法中正确的是( )
| A. | 氢氧化钠的摩尔质量是40g | |
| B. | 1mol氢氧根离子的质量是17g | |
| C. | 1mol氮的质量是14g/mol | |
| D. | 氩气的摩尔质量就是它的相对原子质量 |
13.下列关于金属元素的特征叙述,正确的是( )
| A. | 金属元素的原子只有还原性、金属离子只有氧化性 | |
| B. | 金属元素在化合物中一定显正价 | |
| C. | 金属元素在不同化合物中的化合价都相同 | |
| D. | 金属元素的单质在常温下都呈固态 |
3.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol/L的Ba(NO3)2溶液中含NO3-离子数为2NA | |
| D. | 分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g |
10.依据下面的甲、乙、丙三图,判断下列叙述不正确的是( )
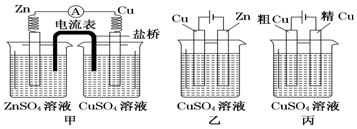

| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙装置中,铜极因发生氧化反应而溶解 | |
| D. | 乙装置中,c(Cu2+)不变,丙装置中,c(Cu2+)减小 |