题目内容
5.下列反应的离子方程式书写中,正确的是( )| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
分析 A.漏写生成水的离子反应;
B.反应生成硫酸镁和水;
C.碳酸钙在离子反应中保留化学式;
D.反应生成硫酸钠、氢气、氢氧化铜.
解答 解:A.硫酸与氢氧化钡在溶液中反应的离子反应为2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故A错误;
B.氢氧化镁溶于稀硫酸的离子反应为2H++Mg(OH)2═Mg2++2H2O,故B正确;
C.大理石与盐酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故C错误;
D.少量金属钠投入到CuSO4溶液中的离子反应为2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列溶液的溶质都是强电解质,这些溶液中的Cl?浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 1mol•L-1NaCl溶液 | B. | 75mL 1mol•L-1 CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1 AlCl3溶液 |
16.常温下,下列离子浓度大小比较正确的是( )
| A. | pH=4的NaHSO3溶液中:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>C(OH-) | |
| B. | 0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,在混合溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 等体积、等浓度的HR溶液和NaOH溶液混合,溶液中一定存在:c(Na+)>c(R-)>c(OH-)>c(H+) | |
| D. | 等体积、等浓度的①CH3COONa②NaNO3③NaClO溶液中离子总数:②>①>③ |
20.下列有关实验的说法正确的是( )
| A. | 在测定中和反应的反应热实验中,只要读一次温度 | |
| B. | 可用pH试纸测定新制氯水的pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向CH3COONa溶液中滴入石蕊试液,溶液变蓝 | |
| E. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
17.下列离子方程式中,正确的是( )
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化钡溶液与硫酸反应:OHˉ+SO42-+Ba2++H+═H2O+BaSO4 | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+OHˉ═H2SiO3 | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
14.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | -3、+5 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
7.A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素.
(1)BF2的结构式为S=C=S.
(2)D和F的氢化物中沸点较高的是H2O(填化学式).
(3)实验室制取G2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为C2H8N2+2N2O4=2CO2+3N2+4H2O.
(7)上述元素可组成盐Q:CA4E(FD4)2.向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
| B | ||
| F |
(2)D和F的氢化物中沸点较高的是H2O(填化学式).
(3)实验室制取G2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为C2H8N2+2N2O4=2CO2+3N2+4H2O.
(7)上述元素可组成盐Q:CA4E(FD4)2.向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.

 ;
;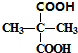 +2C2H5OH$?_{△}^{浓硫酸}$
+2C2H5OH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O. 、
、 .
.