题目内容
16.常温下,下列离子浓度大小比较正确的是( )| A. | pH=4的NaHSO3溶液中:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>C(OH-) | |
| B. | 0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,在混合溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 等体积、等浓度的HR溶液和NaOH溶液混合,溶液中一定存在:c(Na+)>c(R-)>c(OH-)>c(H+) | |
| D. | 等体积、等浓度的①CH3COONa②NaNO3③NaClO溶液中离子总数:②>①>③ |
分析 A.pH=4的NaHSO3溶液中,溶液显酸性,溶液中HSO3-电离大于水解;
B.0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,得到等浓度的NaHCO3和Na2CO3,溶液中碳酸根离子水解程度大于碳酸氢根离子溶液显碱性;
C.等体积、等浓度的HR溶液和NaOH溶液混合,若HR为强酸c(OH-)=c(H+),若HR为弱酸,反应后溶液中c(OH-)>c(H+);
D.等体积、等浓度的①CH3COONa溶液中醋酸根离子水解溶液显碱性,②NaNO3 溶液中离子不水解,溶液呈中性,③NaClO溶液中次氯酸根离子水解溶液显碱性,醋酸根离子水解程度小于次氯酸根离子水解程度,结合溶液电荷守恒比较;
解答 解:A.pH=4的NaHSO3溶液显酸性,溶液中离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>C(OH-),故A错误;
B.0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,得到等浓度的NaHCO3和Na2CO3,溶液中碳酸根离子水解程度大于碳酸氢根离子溶液显碱性,溶液中c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故B错误;
C.等体积、等浓度的HR溶液和NaOH溶液混合,若HR为强酸c(OH-)=c(H+),若HR为弱酸,反应后溶液中c(OH-)>c(H+),离子浓度大小不一定,故C错误;
D.等体积、等浓度的①CH3COONa②NaNO3③NaClO溶液中存在电荷守恒,①c(H+)+c(Na+)=c(OH-)+c(CH3COO-),②溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(NO3-)③溶液中电荷守恒c(H+)+c(Na+)=c(ClO-)+c(OH-),硝酸钠溶液中无离子水解,离子水解离子减小,溶液中醋酸根离子水解程度小于次氯酸根离子,所以离子总数:②>①>③,故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较,酸碱反应后溶液酸碱性的定量分析判断,电解质溶液中盐类水解、弱电解质电离和溶液中电荷守恒的理解应用,题目难度中等.

| A. | 一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) | |
| B. | 在常温下,10 mL 0.2 mol•L-1盐酸与10 mL 0.2 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13 | |
| C. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl-) | |
| D. | 5 mL 1 mol•L-1 CH3COONa溶液与5 mL 1 mol•L-1盐酸混合液中c(Cl-)=c(Na+)>c(H+)>c(OH-) |
| A. |  | B. | Fe3+ | C. |  | D. |  |
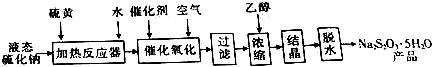
回答下列问题:
(1)反应器中Na2S与S按物质的量之比1:1反应的离子方程式为S2-+S=2S2-,反应器需加热的目的是使Na2S与S能充分反应
(2)氧化时,加入催化剂[m(MnSO4):m(NiSO4•7H2O)=1:4],测得不同温度下完全氧化所需时间如表:
| 溶液温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 氧化完全所需时间/h | 6 | 5.5 | 5.5 | 6 | 20 | 16 | 11 | 11 |
(3)过滤时,滤渣的主要成分为硫及液态硫化钠原料中的杂质,浓缩时加入适量乙醇的目的是减小Na2S2O3的溶解度.
| A. |  石油的分馏 | B. |  分离硝基苯和水 | ||
| C. |  除去甲烷中的乙烯 | D. | 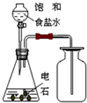 制取并收集乙炔气体 |
| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |