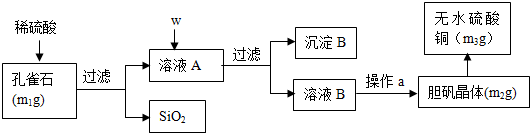
题目内容
8.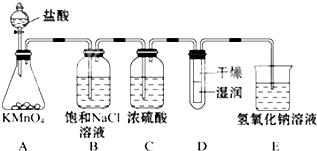 工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)(1)用装置A制备Cl2,该同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未顺利流下,你认为原因可能是:分液漏斗上端活塞未打开.
(2)配平KMnO4与盐酸反应的化学方程式:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中氧化剂和还原剂的物质的量之比为1:5.
(3)饱和食盐水的作用是吸收Cl2中的HCl,浓硫酸的作用吸收Cl2中的H2O,装置E的作用是吸收尾气,防止污染空气.
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示)SO2+Cl2+2H2O=H2SO4+2HCl.
(5)配制450mL物质的量浓度为0.4mol•L-1NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和500mL容量瓶,需用托盘天平称量NaOH的质量是8.0g.
分析 (1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)分析元素中化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以利用饱和食盐水除去氯气中混有的氯化氢气体,减小氯气溶解度,浓硫酸具有吸水性,能够干燥氯气;氯气有毒,直接排放能够引起污染,需要进行尾气处理;
(4)依据氯气与二氧化硫在水溶液中发生氧化还原反应生成盐酸和硫酸结合硫酸和盐酸无漂白性解答;
(5)配制450mL溶液,应选择500ml容量瓶,依据m=CVM计算需要氢氧化钠的质量.
解答 解:(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开;
故答案为:分液漏斗上端活塞未打开;
(2)反应中高锰酸钾中+7价锰降为氯化锰中+2价,高锰酸钾做氧化剂,氯化氢中-1价氯部分升高为氯气中0价,氯化氢做还原剂,依据得失电子守恒,则氯气系数为5,高锰酸钾系数为2,依据原子个数守恒,反应方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8 H2O;反应中消耗2mol高锰酸钾,则有10mol氯化氢被氧化,所以氧化剂和还原剂的物质的量之比为1:5;
故答案为:2;16;2;2;5;8; 1:5;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以利用饱和食盐水除去氯气中混有的氯化氢气体,减小氯气溶解度,浓硫酸具有吸水性,能够干燥氯气;氯气有毒,直接排放能够引起污染,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可以用装有氢氧化钠溶液的E吸收过量的氯气;
故答案为:吸收Cl2中的HCl;吸收Cl2中的H2O;吸收尾气,防止污染空气;
(4)氯气与二氧化硫在水溶液中发生氧化还原反应生成盐酸和硫酸,反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,盐酸和硫酸不具有漂白性,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)配制450mL溶液,应选择500mL容量瓶,需称量的NaOH的质量为:0.4mol•L-1×0.5L×40g/mol=8.0g,
故答案为:500 mL容量瓶;8.0 g.
点评 本题考查了氯溴碘的性质实验,题目难度中等,涉及氧化还原反应的配平、一定物质的量浓度溶液的配制、化学方程式书写等知识,明确氯气的制备原理和性质是解题关键,试题培养了学生的分析能力及灵活应用能力.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | Na | B. | Mg | C. | Cu | D. | Zn |
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ④⑤②①③ |
 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
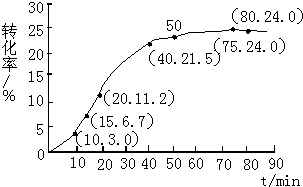
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)上述反应的平衡常数表达式为:K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$,则该反应在温度T1下的K值为$\frac{1}{7}$.
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
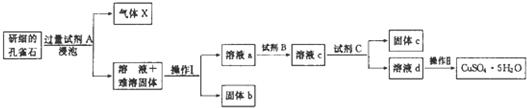
(1)试剂A的化学式是H2SO4;操作I的名称是过滤;
(2)操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方式:2Fe2++2H++H2O2=2Fe3++2H2O.
(4)已知
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuCO3
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7~4.8.
(5)溶液c中含有的两种金属阳离子,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.
 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.