题目内容
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 30g C2H6中含有的共用电子对数为6NA | |
| B. | 1.0L 1.0mol•L-1Na3PO4水溶液中含有的氧原子数为4NA | |
| C. | 1 mol FeI2与足量氯气反应转移的电子数为3NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
分析 A.求出乙烷的物质的量,然后根据乙烷中含7对共用电子对来分析;
B.溶液中存在水的电离平衡;
C.碘化亚铁与氯气反应生成氯化铁和单质碘,1mol碘化亚铁反应失去3mol电子;
D.pH=13的溶液中氢氧根离子的浓度为0.1mol/L,根据n=cV计算出氢氧根离子的物质的量.
解答 解:A.30g乙烷的物质的量为1mol,而乙烷中含7对共用电子对,故1mol乙烷中含7NA对共用电子对,故A错误;
B.1.0L 1.0mol•L-1Na3PO4水溶液中,含有水,溶液中含有的氧原子数大于4 NA,故B错误;
C.碘化亚铁与氯气反应生成氯化铁和单质碘,1mol FeI2与足量氯气反应时转移的电子数为3NA,故C正确;
D.pH=13的溶液中氢氧根离子的浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故D错误,
故选:C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,本题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
6.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA | |
| C. | 标准状况下,B2H6(g)和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 在浓硫酸作用下,60g冰醋酸与足量无水乙醇反应生成乙酸乙酯的分子数为NA |
10.下列说法正确的是( )
| A. | 铅蓄电池工作时,电解质溶液H2SO4的浓度不变 | |
| B. | 加水稀释0.1 mol•L-1CH3COOH溶液时,CH3COOH的电离程度增大,pH减小 | |
| C. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4×6.02×1023个 |
17.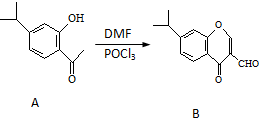 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中至少有8个碳原子位于同一平面 | |
| B. | 1molA与浓溴水发生取代反应时,最多消耗3molBr2 | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与6mol H2发生加成反应 |
7.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,11.2L C2H6中含有共价键的数目为3.5NA | |
| B. | 通常状况下,2.0 g H2 和1 mol Cl2反应后的气体分子数目为2NA | |
| C. | 1molAl分别与足量的盐酸、足量的NaOH溶液反应,转移的电子数都是3NA | |
| D. | 将3.4g H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
14.下列离子方程式书写不正确的是( )
| A. | 氨气通入醋酸溶液中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向苯酚纳溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 等物质的量Cl2与FeBr2在溶液反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 惰性电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
11. 工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
 工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )
工业上利用电化学方法将SO2废气二次利用,制备保险粉(Na2S2O4)的装置如图所示,下列说法正确的是( )| A. | 电极Ⅱ为阳极,发生还原反应 | |
| B. | 通电后H+通过阳离子交换膜向电极Ⅰ方向移动,电极Ⅱ区溶液pH增大 | |
| C. | 阴极区电极反应式为:2SO2+2e-═S2O42- | |
| D. | 若通电一段时间后溶液中H+转移0.1mol,则处理标准状况下SO2废气2.24L |
19.研究物质的微观结构,有助于人们理解物质变化的本质.请回答:
(1)C、N、O元素的第一电离能由大到小的顺序是N>O>C.
(2)A、B均为短周期金属元素.依据下表数据,
写出B原子的电子排布式1s22s22p63s2.
(3)①COCl2分子的结构式为 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
(4)甲苯结构简式: ,其中C原子采用的轨道杂化方式有sp2、sp3.
,其中C原子采用的轨道杂化方式有sp2、sp3.
(5)ClO3-离子的立体构型是三角锥形,写出一种与ClO3-互为等电子体的微粒的化 学式SO32-(IO3-BrO3-NCl3).
(6)比较C、Si、N元素形成简单的氢化物稳定性高低并说明理由稳定性:NH3>CH4>SiH4,因为键长N-H<C-H<Si-H,又键长越短,键能越大,所以稳定性
为NH3>CH4>SiH4.
(1)C、N、O元素的第一电离能由大到小的顺序是N>O>C.
(2)A、B均为短周期金属元素.依据下表数据,
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(3)①COCl2分子的结构式为
 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号);A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
(4)甲苯结构简式:
 ,其中C原子采用的轨道杂化方式有sp2、sp3.
,其中C原子采用的轨道杂化方式有sp2、sp3.(5)ClO3-离子的立体构型是三角锥形,写出一种与ClO3-互为等电子体的微粒的化 学式SO32-(IO3-BrO3-NCl3).
(6)比较C、Si、N元素形成简单的氢化物稳定性高低并说明理由稳定性:NH3>CH4>SiH4,因为键长N-H<C-H<Si-H,又键长越短,键能越大,所以稳定性
为NH3>CH4>SiH4.
