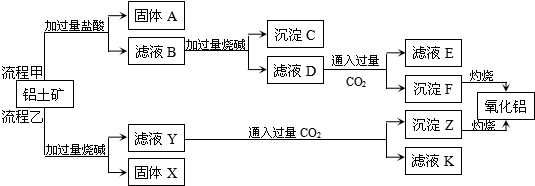
题目内容
5.为了讲授“氯气的性质和用途”,A老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行教学.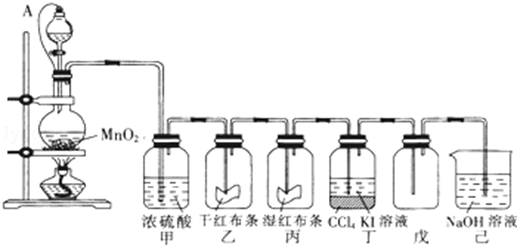
试回答下列问题:
(1)乙和丙中的现象分别是干燥的红布条不褪色、湿润的红布条褪色;
(2)分离丁中液体的方法是分液;
(3)烧瓶内发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)分液漏斗与烧瓶连接橡皮管的目的是有利于球形分液漏斗里浓盐酸顺利流入烧瓶里;
(5)将产生的Cl2通入FeCl2溶液中得到含有FeCl2和FeCl3的混合物,实验测得混合物中n(Fe元素):n(Cl元素)=1:2.4,则该溶液中Fe2+和Fe3+的物质的量浓度之比约为3:2.
分析 (1)依据氯气不具有漂白性,次氯酸具有漂白性解答;
(2)氯气与碘化钾反应生成碘单质,碘易溶于四氯化碳,四氯化碳不溶于水,密度大于水;
(3)二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(4)根据针头的作用判断压强的大小,气体的压强有利于分液漏斗内的液体顺利流下;
(5)设二价铁离子物质的量为x,三价铁离子的物质的量为y,依据n(Fe元素):n(Cl元素)=1:2.4计算解答.
解答 解:(1)氯气不具有漂白性,次氯酸具有漂白性,通入到乙中的氯气为干燥氯气,所以不能使红色布条褪色,通入丙中的氯气与湿润布条中的水反应生成据有漂白性的次氯酸,所以有色布条褪色;
故答案为:干燥的红布条不褪色; 湿润的红布条褪色;
(2)氯气与碘化钾反应生成碘单质,碘易溶于四氯化碳,四氯化碳不溶于水,密度大于水,溶于分层,所以可以用分液的方法分离;
故答案为:分液;
(3)二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)利用针头的橡皮管连接后,分液漏斗与烧瓶内气压相等,有利于液体流下;
故答案为:有利于球形分液漏斗里浓盐酸顺利流入烧瓶里;
(5))设二价铁离子物质的量为x,三价铁离子的物质的量为y,则氯离子的物质的量为2x+3y,
依据n(Fe元素):n(Cl元素)=1:2.4可知:(x+y):(2x+3y)=1:2.4,解得x:y=3:2,
故答案为:3:2.
点评 本题考查了氯气的制取、性质,明确氯气制备原理及氯气、次氯酸的性质是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案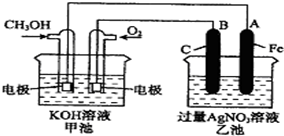 如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )
如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )| A. | 甲池是燃料电池,其中通入氧气的一极是原电池的正极 | |
| B. | 乙池是电解池,铁电极是阴极,一段时间后会析出金属银 | |
| C. | 甲池是电解池,乙是原电池 | |
| D. | 甲池一段时间后溶液的pH值会变小 |
通过测定溶液变蓝所用时间来探究外界-条什对该反应速率的影响,记录如下:
| 编号 | 0.01mol/LNaHSO3溶液(mL) | 0.01mol/LKIO3溶液(mL) | H2O(mL) | 反应温度(℃) | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
| A. | “纳米碳”属于“纳米材料”,若将纳米碳均匀地分散到蒸馏水中,所形成的物质能透过滤纸,不能透过半透膜,静置后会析出黑色沉淀 | |
| B. | 维生素C又称“抗坏血酸”,在人体内有重要的功能,是因为维生素C具有氧化性 | |
| C. | 表面打磨过的铝箔,在空气中加热至熔化也不滴落是因为表面生成了熔点很高的氧化铝薄膜包裹在铝的外面 | |
| D. | 氨很容易液化,液化时放热,液化后得到氨水 |
| A. | 氯气是一种有毒气体,不能用于自来水的杀菌消毒 | |
| B. | 高纯度的二氧化硅晶体广泛用作制造光导纤维 | |
| C. | 氧化铝可用于冶炼金属铝的原料,也是一种比较好的耐火材料 | |
| D. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
| A. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氟酸盛装在细口玻璃瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
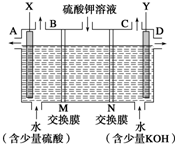 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾. 如图是实验室制取氨气的装置图,请回答:
如图是实验室制取氨气的装置图,请回答: